هیدرولیز چیست؟ | آبکافت در شیمی و صنایع
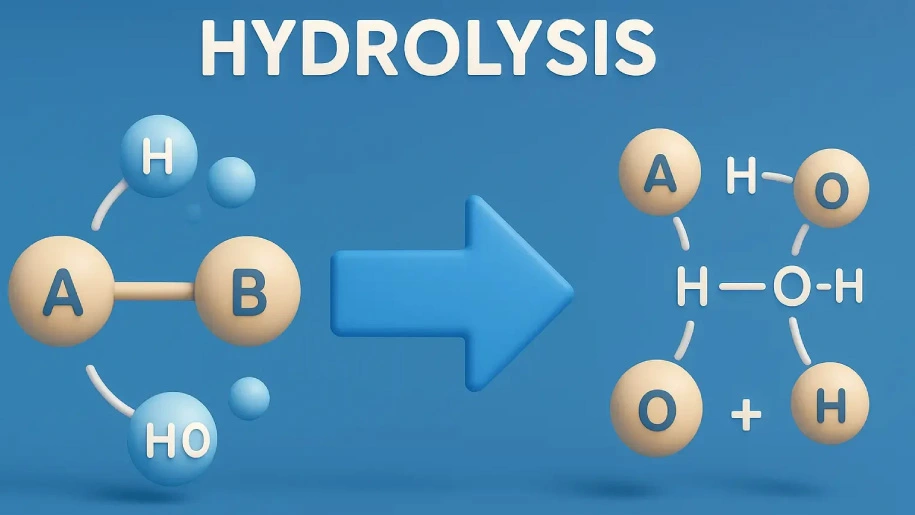
هیدرولیز یا آبکافت یکی از واکنشهای پایهای در شیمی است که طی آن مولکول آب باعث شکستن یک پیوند شیمیایی میشود. این واکنش ساده در ظاهر، نقش حیاتی در طبیعت و صنعت دارد. از فرآیندهای زیستی مانند هضم کربوهیدراتها و پروتئینها گرفته تا کاربردهای صنعتی همچون تولید شربت گلوکز، صابون و برخی داروها، همگی نمونههایی از هیدرولیز هستند.
اهمیت این واکنش در آن است که ترکیبات پیچیده را به واحدهای سادهتر تبدیل میکند و بستر ایجاد مواد جدید را فراهم میآورد. در ادامه، بهصورت گامبهگام با تعریف دقیق، مکانیسم، انواع و کاربردهای هیدرولیز (آبکافت) آشنا میشویم.
هیدرولیز یا آبکافت چیست؟
هیدرولیز که در زبان فارسی «آبکافت» نامیده میشود، یکی از واکنشهای مهم شیمیایی است که طی آن یک پیوند کووالانسی در حضور آب شکسته میشود. در این واکنش، مولکول آب تنها یک حلال منفعل نیست، بلکه بهطور مستقیم در شکست پیوند نقش دارد. اتم هیدروژن (H⁺) و گروه هیدروکسیل (OH⁻) حاصل از آب به اجزای مختلف مولکول هدف متصل میشوند و دو ترکیب جدید را شکل میدهند.
اهمیت هیدرولیز در این است که امکان تبدیل مولکولهای بزرگ و پیچیده به ترکیبات کوچکتر و سادهتر را فراهم میکند. این واکنش میتواند روی پیوندهای مختلفی از جمله استری، آمیدی، گلیکوزیدی یا حتی برخی پیوندهای معدنی رخ دهد. به همین دلیل، در بسیاری از شاخههای شیمی و زیستشناسی مشاهده میشود.
برای درک بهتر میتوان گفت:
- زمانی که یک استر در آب شکسته میشود، حاصل واکنش یک اسید کربوکسیلیک و یک الکل است.
- وقتی یک آمید تحت هیدرولیز قرار میگیرد، محصول نهایی یک اسید کربوکسیلیک و یک آمین خواهد بود.
- حتی در شیمی معدنی نیز، برخی نمکها هنگام حل شدن در آب دچار هیدرولیز میشوند و موجب تغییر pH محیط میگردند.
بنابراین، هیدرولیز یا آبکافت نه یک واکنش خاص محدود، بلکه یک مفهوم عمومی است که در طیف وسیعی از ترکیبات و شرایط رخ میدهد. همین گستردگی باعث شده در متون علمی و صنعتی، هیدرولیز بهعنوان یکی از واکنشهای پایهای در نظر گرفته شود.
مکانیسم واکنش هیدرولیز
آبکافت یک واکنش شکستن پیوند است که در آن آب مستقیماً وارد عمل میشود. اساس کار به این صورت است که مولکول آب به یونهای H⁺ و OH⁻ تفکیک میشود و هر کدام به یکی از بخشهای مولکول هدف متصل میگردند. این فرآیند موجب میشود یک پیوند کووالانسی موجود در ترکیب شکسته شده و دو محصول جدید ایجاد شود.
از نظر کلی، مکانیسم آبکافت را میتوان در چند گام توصیف کرد:
- فعالسازی مولکول آب: تحت شرایط خاص (حضور کاتالیزور اسیدی، بازی یا آنزیم)، پیوند O–H در آب قطبیتر شده و به H⁺ و OH⁻ تجزیه میشود.
- حمله نوکلئوفیلی: یون هیدروکسیل (OH⁻) به عنوان یک نوکلئوفیل به مرکز الکتروندوست مولکول هدف (مثلاً کربن کربونیل در استر یا آمید) حمله میکند.
- تشکیل حالت گذار: در این مرحله یک کمپلکس ناپایدار ایجاد میشود که نشاندهنده جابهجایی پیوندهاست.
- شکست پیوند: یکی از پیوندهای اصلی در ترکیب اولیه میشکند و همراه با اتصال H⁺ به بخش دیگر مولکول، دو محصول جدید شکل میگیرند.
مثال ساده:
- در آبکافت یک استر، گروه OH⁻ به کربن کربونیل حمله میکند، پیوند استری شکسته میشود و در نهایت یک اسید کربوکسیلیک و یک الکل تشکیل میشود.
- در آبکافت نمکهای معدنی (مانند استات سدیم)، یونهای حاصل از نمک با یونهای آب واکنش داده و محیط محلول را به سمت اسیدی یا بازی تغییر میدهند.
نکته مهم این است که مکانیسم هیدرولیز بسته به شرایط واکنش میتواند متفاوت باشد:
- هیدرولیز اسیدی: یون H⁺ بهعنوان کاتالیزور عمل کرده و سرعت واکنش را افزایش میدهد.
- هیدرولیز بازی: یون OH⁻ مستقیماً به پیوند هدف حمله میکند و شکستن را تسهیل مینماید.
- هیدرولیز آنزیمی: در موجودات زنده، آنزیمها شرایط ایدهآل را برای این واکنش فراهم میکنند تا واکنش با سرعت و انتخابپذیری بالا انجام شود.
انواع هیدرولیز
هیدرولیز یا آبکافت، بسته به شرایط واکنش و نوع ترکیباتی که درگیر میشوند، میتواند به شکلهای مختلفی رخ دهد. تقسیمبندی این واکنشها معمولاً بر اساس عامل کاتالیزکننده یا نوع پیوندی است که شکسته میشود. در ادامه، مهمترین انواع هیدرولیز بررسی میشوند.
هیدرولیز شیمیایی
در این نوع، واکنش با استفاده از مواد شیمیایی معدنی مثل اسیدها و بازها انجام میشود.
- هیدرولیز اسیدی: در حضور یک اسید قوی مانند HCl یا H₂SO₄، مولکول آب فعالتر شده و توانایی شکستن پیوندها را پیدا میکند. مثال بارز آن آبکافت استرها برای تولید اسید کربوکسیلیک و الکل است.
- هیدرولیز بازی (صابونسازی): در این حالت، باز قوی مانند NaOH یا KOH عامل اصلی واکنش است. این روش برای تجزیه چربیها و تولید صابون و گلیسرول استفاده میشود.
ویژگی مهم آبکافت شیمیایی این است که میتواند در مقیاس صنعتی با راندمان بالا انجام شود، اما کنترل دقیق شرایط (pH و دما) ضروری است تا واکنشهای جانبی به حداقل برسند.
هیدرولیز آنزیمی
در موجودات زنده، هیدرولیز معمولاً توسط آنزیمها کاتالیز میشود. آنزیمها با فراهم کردن شرایط واکنش و کاهش انرژی فعالسازی، سرعت آبکافت را بهطور چشمگیری افزایش میدهند.
نمونهها:
- آمیلازها: تجزیه نشاسته به قندهای سادهتر مانند گلوکز.
- پروتئازها: شکستن پیوندهای پپتیدی در پروتئینها و تبدیل آنها به آمینواسید.
- لیپازها: هیدرولیز چربیها به اسیدهای چرب و گلیسرول.
این نوع هیدرولیز، انتخابپذیری بسیار بالایی دارد؛ یعنی آنزیم تنها روی یک نوع پیوند یا مولکول خاص عمل میکند. به همین دلیل، آبکافت آنزیمی در صنایع غذایی و دارویی جایگاه مهمی دارد.
هیدرولیز بیولوژیکی
هیدرولیز بیولوژیکی به فرآیندهایی گفته میشود که در سیستمهای زنده یا محیطهای زیستی رخ میدهند. در این حالت، آنزیمها و گاهی شرایط طبیعی (رطوبت، دما) باعث شکستن ترکیبات آلی میشوند.
مثالها:
- تجزیه کربوهیدراتها در بدن به مونوساکاریدها.
- شکستن پروتئینها به آمینواسیدها در دستگاه گوارش.
- تجزیه طبیعی مواد آلی در محیط زیست (مثل ضایعات گیاهی و حیوانی).
اهمیت این دسته در نقش آن در چرخههای طبیعی مواد و همچنین فرآیندهای زیستتجزیهپذیری است.
هیدرولیز معدنی و نمکها
برخی ترکیبات معدنی، بهویژه نمکهای حاصل از اسیدهای ضعیف و بازهای ضعیف، هنگام حل شدن در آب دچار هیدرولیز میشوند.
- مثال: استات سدیم در آب باعث ایجاد محیط بازی میشود.
- اهمیت: این نوع فرایند در شیمی محلولها و کنترل pH کاربرد دارد.
انواع هیدرولیز را میتوان بر اساس شرایط (شیمیایی، آنزیمی، بیولوژیکی) یا نوع ترکیب (آلی و معدنی) طبقهبندی کرد. هر کدام از این دستهها نهتنها از نظر علمی اهمیت دارند، بلکه در حوزههای صنعتی و زیستی نیز نقشهای متفاوتی ایفا میکنند.
عوامل مؤثر بر سرعت هیدرولیز
سرعت آبکافت، مانند هر واکنش شیمیایی دیگر، به مجموعهای از شرایط محیطی و ویژگیهای مولکول هدف بستگی دارد. شناخت این عوامل برای کنترل واکنش در مقیاس آزمایشگاهی و صنعتی اهمیت زیادی دارد. مهمترین عوامل عبارتاند از:
۱. pH محیط
- محیط اسیدی (حضور یون H⁺) باعث فعالتر شدن مولکول آب و تسهیل شکستن پیوندهای استری و آمیدی میشود.
- محیط بازی (حضور یون OH⁻) موجب حمله مستقیم نوکلئوفیلی و افزایش سرعت واکنش میشود.
مثال: در تولید صابون، استفاده از NaOH سرعت آبکافت چربیها را بهطور چشمگیری افزایش میدهد.
۲. دما
افزایش دما معمولاً موجب افزایش سرعت هیدرولیز میشود، زیرا انرژی بیشتری برای غلبه بر سد انرژی فعالسازی فراهم میکند.
- در واکنشهای صنعتی، دما معمولاً بین ۶۰ تا ۱۵۰ درجه سانتیگراد تنظیم میشود.
- در مقابل، در واکنشهای زیستی، دما باید ملایم باشد (۳۵ تا ۴۰ درجه سانتیگراد) تا به آنزیمها آسیبی نرسد.
۳. کاتالیزورها
کاتالیزورها با کاهش انرژی فعالسازی واکنش را تسریع میکنند.
- کاتالیزورهای اسیدی و بازی: مانند H₂SO₄ و NaOH.
- آنزیمها: مانند آمیلاز، پروتئاز و لیپاز که واکنشهای زیستی را با انتخابپذیری بالا هدایت میکنند.
حضور آنزیم میتواند سرعت واکنش را میلیونها برابر افزایش دهد.
۴. ساختار مولکول هدف
- پیوندهای ضعیفتر (مانند پیوند استری) سریعتر هیدرولیز میشوند.
- مولکولهای دارای گروههای الکترونکشنده در نزدیکی پیوند، راحتتر مورد حمله نوکلئوفیل قرار میگیرند.
- مولکولهای بزرگ و پیچیده (مثل پلیساکاریدها) نیاز به آنزیمهای خاص یا شرایط شدیدتر دارند.
۵. حلال و محیط واکنش
اگرچه هیدرولیز ذاتاً به آب وابسته است، اما وجود حلالهای کمکی (مانند اتانول یا حلالهای قطبی دیگر) میتواند سرعت واکنش را تغییر دهد. همچنین غلظت آب و میزان دسترسی آن به پیوندها نیز عامل مهمی است.
نتیجه: سرعت آبکافت را میتوان با کنترل pH، دما، استفاده از کاتالیزور مناسب و طراحی شرایط واکنش بهطور دقیق مدیریت کرد. همین مسئله سبب شده که هیدرولیز در مقیاس صنعتی و زیستی، بهطور گسترده قابلپیادهسازی باشد.
کاربردهای هیدرولیز (آبکافت)
هیدرولیز به دلیل ماهیت بنیادی خود، در حوزههای متنوعی از علوم و صنایع حضور دارد. گستردگی این واکنش بهگونهای است که میتوان آن را در سه دسته کلی زیستی، شیمیایی–صنعتی و محیطزیستی بررسی کرد.
۱. کاربردهای زیستی
- گوارش و متابولیسم: واکنشهای هیدرولیز اساس فرآیندهای گوارشی در انسان و جانوران هستند. کربوهیدراتها، پروتئینها و چربیها در دستگاه گوارش به کمک آنزیمهای هیدرولیتیک به واحدهای سادهتر (مانند مونوساکارید، آمینواسید و اسید چرب) شکسته میشوند. این واکنشها امکان جذب و استفاده از مواد غذایی را فراهم میکنند.
- چرخههای زیستی: در مسیرهای زیستمولکولی همچون چرخه ATP و ADP، هیدرولیز نقش کلیدی در آزادسازی انرژی دارد. بدون این واکنش، انتقال انرژی در سلولها امکانپذیر نخواهد بود.
- تجزیه بیومولکولها: آبکافت پیوندهای فسفودیاستر در DNA و RNA یا پیوندهای پپتیدی در پروتئینها بخش مهمی از فرآیندهای طبیعی سلولی است. این موضوع نهتنها در متابولیسم، بلکه در کنترل بیان ژن و سنتز پروتئین نیز حیاتی است.
۲. کاربردهای شیمیایی و صنعتی
- تجزیه استرها و آمیدها: در صنایع شیمیایی از آبکافت برای شکستن پیوندهای استری و آمیدی استفاده میشود. این واکنش پایه بسیاری از سنتزهای آلی و تولید محصولات واسطهای است.
- تولید مواد شوینده و صابون: فرآیند صابونی شدن نمونهای مهم از هیدرولیز بازی است که طی آن چربیها و روغنها به گلیسرول و نمکهای اسید چرب (صابون) تبدیل میشوند.
- صنایع پلیمر: هیدرولیز در تولید، اصلاح و بازیافت پلیمرها کاربرد دارد. کنترل این واکنش در سنتز پلیاسترها و پلیآمیدها اهمیت ویژهای دارد و در بازیافت نیز به تجزیه زنجیرههای بلند به مونومرهای اولیه کمک میکند.
- صنایع غذایی: هیدرولیز نشاسته برای تولید گلوکز و مالتوز، آبکافت پروتئین برای بهبود قابلیت جذب و هیدرولیز لاکتوز برای تولید فرآوردههای بدون لاکتوز از کاربردهای کلیدی در این حوزه هستند.
- صنایع دارویی: بسیاری از داروها به شکل پیشدارو (Prodrug) عرضه میشوند و تنها پس از هیدرولیز در بدن فعال میشوند. همچنین در تولید مواد مؤثره دارویی، آبکافت برای حذف گروههای محافظ یا فعالسازی ترکیبات بهکار میرود.
- فرآیندهای معدنی و کاتالیستی: برخی ترکیبات معدنی و فلزی نیز در واکنشهای هیدرولیز وارد میشوند؛ برای نمونه در شیمی سل–ژل، هیدرولیز آلکوکسیدهای فلزی نخستین گام در تولید سرامیکها و پوششهای مقاوم است.
۳. کاربردهای محیطزیستی و انرژی
- تصفیه فاضلاب: در مراحل بیولوژیکی تصفیه، هیدرولیز باعث شکستن مواد آلی پیچیده به ترکیبات سادهتر میشود و زمینه را برای تخمیر و اکسیداسیون فراهم میکند.
- زیستتجزیهپذیری پلیمرها: بسیاری از پلیمرهای نوین بهگونهای طراحی میشوند که در تماس با آب و آنزیمها دچار هیدرولیز شوند و به ترکیبات غیرسمی تجزیه گردند. این ویژگی در مدیریت پسماندهای پلاستیکی اهمیت دارد.
- تولید انرژی زیستی: هیدرولیز سلولز و همیسلولز به قندهای ساده، مرحله اصلی در تولید اتانول زیستی و دیگر سوختهای تجدیدپذیر است. بدون این واکنش، دسترسی به انرژی ذخیرهشده در زیستتوده امکانپذیر نخواهد بود.
- چرخه طبیعی مواد: در محیطهای آبی و خاکی، آبکافت بهطور طبیعی موجب تجزیه مواد آلی و معدنی میشود و به تعادل زیستمحیطی کمک میکند.
آبکافت بهعنوان یکی از واکنشهای پایه، نهتنها در سطح زیستی برای بقا و متابولیسم موجودات زنده حیاتی است، بلکه در صنایع شیمیایی، غذایی، دارویی و پلیمر نقشی محوری دارد. همچنین، اهمیت آن در حوزههای محیطزیست و انرژیهای تجدیدپذیر روزبهروز بیشتر میشود. گسترهی این کاربردها نشان میدهد که هیدرولیز تنها یک واکنش تئوری آزمایشگاهی نیست، بلکه بخشی جدانشدنی از علم و صنعت مدرن به شمار میرود.
تفاوت هیدرولیز و واکنشهای مشابه
اگرچه آبکافت یکی از شناختهشدهترین واکنشهای شیمیایی است، اما گاهی با فرآیندهای مشابهی مانند کندانساسیون، تجزیه حرارتی و اکسیداسیون اشتباه گرفته میشود. شناخت تفاوت این واکنشها کمک میکند تا جایگاه دقیق هیدرولیز بهتر درک شود.
۱. هیدرولیز در برابر کندانساسیون
- هیدرولیز: یک پیوند شیمیایی با استفاده از آب شکسته میشود و مولکول به اجزای کوچکتر تقسیم میشود.
- کندانساسیون: برعکس آبکافت، طی آن دو مولکول کوچک با هم ترکیب میشوند و یک مولکول بزرگتر تشکیل میدهند، در حالی که یک مولکول آب بهعنوان محصول جانبی آزاد میشود.
به زبان ساده، هیدرولیز و کندانساسیون دو واکنش معکوس هستند.
۲. آبکافت در برابر تجزیه حرارتی
- آبکافت: شکستن پیوندها به کمک آب و غالباً در حضور کاتالیزور اسیدی، بازی یا آنزیمی رخ میدهد.
- تجزیه حرارتی: شکستن پیوندها صرفاً در اثر دما و بدون حضور آب انجام میشود. نمونه آن تجزیه حرارتی پلیمرها یا نفت است.
تفاوت اصلی در حضور آب و شرایط ملایمتر آبکافت است.
۳. آبکافت در برابر اکسیداسیون
- آبکافت: آب عامل اصلی واکنش است و محصول واکنش معمولاً ترکیبات سادهتر ولی پایدار هستند.
- اکسیداسیون: در این واکنش، انتقال الکترون به اکسیژن یا یک عامل اکسیدکننده صورت میگیرد. نتیجه آن تغییر عدد اکسایش و تولید ترکیباتی با انرژی متفاوت است.
بنابراین، آبکافت یک واکنش شکست پیوند است، در حالی که اکسیداسیون واکنشی مبتنی بر تغییر حالت الکترونی عناصر است.
۴. جایگاه آبکافت در میان این واکنشها
آنچه هیدرولیز را متمایز میکند، نقش فعال آب در فرآیند شکستن پیوند است. در حالی که بسیاری از واکنشهای دیگر یا بر پایهی ترکیب مولکولها (مانند کندانساسیون) یا تغییرات انرژی بالا (مانند تجزیه حرارتی و اکسیداسیون) عمل میکنند، آبکافت با استفاده از آب و در شرایط کنترلشده پیوندها را میشکند و ترکیبات جدید ایجاد میکند.
مزایا و محدودیتهای هیدرولیز
آبکافت بهعنوان یکی از واکنشهای بنیادی در شیمی و زیستشناسی، ویژگیهای مثبت قابلتوجهی دارد، اما مانند هر فرآیند دیگر با محدودیتهایی نیز همراه است. شناخت این جنبهها به ما کمک میکند تا کاربردهای آن را بهتر مدیریت کنیم و در شرایط مناسب از آن بهره ببریم.
مزایا
- سادگی و گستردگی: هیدرولیز در شرایط مختلف (اسیدی، بازی، آنزیمی) قابل انجام است و دامنه وسیعی از ترکیبات آلی و معدنی را شامل میشود.
- اهمیت زیستی: این واکنش اساس بسیاری از فرآیندهای حیاتی مانند گوارش، متابولیسم و انتقال انرژی سلولی است.
- کاربرد صنعتی متنوع: در صنایع غذایی، دارویی، شیمیایی، پلیمر و انرژیهای تجدیدپذیر کاربرد مستقیم دارد.
- امکان کنترل واکنش: با تغییر pH، دما یا نوع کاتالیزور، میتوان سرعت و انتخابپذیری واکنش را تنظیم کرد.
- نقش زیستمحیطی: هیدرولیز در تجزیه ضایعات آلی و زیستتجزیهپذیری پلیمرها سهم مهمی دارد و به کاهش آلودگی کمک میکند.
محدودیتها
- نیاز به شرایط خاص: بسیاری از واکنشهای هیدرولیز تنها در حضور کاتالیزورهای قوی یا آنزیمهای تخصصی بهطور مؤثر انجام میشوند.
- مصرف انرژی: در مقیاس صنعتی، اغلب به دما و فشار بالا نیاز است که موجب افزایش هزینه انرژی میشود.
- واکنشهای جانبی: کنترلنکردن شرایط میتواند منجر به تولید ترکیبات ناخواسته شود.
- محدودیت آنزیمی: آنزیمهای کاتالیزکننده آبکافت حساس به دما و pH هستند و در خارج از شرایط بهینه عملکرد خود را از دست میدهند.
- مقیاسپذیری دشوار: برخی واکنشهای هیدرولیز که در مقیاس آزمایشگاهی موفق هستند، در مقیاس صنعتی به دلیل هزینه یا پیچیدگی قابل پیادهسازی نیستند.
نتیجه: آبکافت یک واکنش قدرتمند و حیاتی است، اما برای بهرهبرداری مؤثر از آن باید محدودیتهایش را در نظر گرفت و شرایط بهینه را طراحی کرد.
جمعبندی
آبکافت یکی از واکنشهای بنیادی در شیمی و زیستشناسی است که طی آن، یک پیوند شیمیایی به کمک مولکول آب شکسته میشود. این فرآیند ساده در ظاهر، اما حیاتی در عملکرد، در گسترهای وسیع از پدیدههای طبیعی و صنعتی نقش دارد.
در این مقاله دیدیم که:
- آبکافت بهعنوان واکنشی عمومی میتواند روی پیوندهای استری، آمیدی، گلیکوزیدی و حتی معدنی رخ دهد.
- مکانیسم آن بر پایه شکستن پیوند کووالانسی با ورود یونهای H⁺ و OH⁻ است.
- انواع آبکافت شامل شیمیایی، آنزیمی، بیولوژیکی و معدنی میشوند که هرکدام شرایط و کاربرد خاص خود را دارند.
- سرعت و کارایی این واکنش به عواملی همچون pH، دما، کاتالیزورها و ساختار مولکول بستگی دارد.
- دامنه کاربردهای هیدرولیز از زیستشناسی و پزشکی تا صنایع غذایی، دارویی، شیمیایی و انرژیهای تجدیدپذیر را دربر میگیرد.
- با وجود مزایای متعدد، محدودیتهایی مانند نیاز به شرایط خاص، حساسیت آنزیمها و هزینه بالای انرژی در مقیاس صنعتی نیز وجود دارد.
به همین دلیل، آبکافت نهتنها درک پایهای از واکنشهای شیمیایی را تقویت میکند، بلکه دریچهای به سوی فناوریهای پیشرفته و کاربردهای صنعتی گسترده میگشاید.