هالوژناسیون چیست؟ راهنمای جامع
فرآیند هالوژناسیون یکی از واکنشهای بنیادی در شیمی آلی است که اثرات آن در صنایع مختلف، از تولید پلیمرهای پیشرفته تا ضدعفونی آب آشامیدنی، مشاهده میشود. به طور دقیق، هالوژناسیون به هر واکنش شیمیایی گفته میشود که در طی آن، یک یا چند اتم از خانواده هالوژنها (فلوئور، کلر، برم یا ید) به یک ترکیب آلی یا غیرآلی افزوده شده یا جایگزین اتمی دیگر در آن ترکیب میشود.
در این مقاله، به تحلیل فنی و جامع این فرآیند کلیدی میپردازیم. در این راهنما، از اصول بنیادی و مقایسه واکنشپذیری هالوژنها گرفته تا تحلیل عمیق مکانیزمهای واکنش بر روی ترکیبات مختلف و بررسی کاربردهای گسترده صنعتی، تمام جوانب موضوع را به صورت دقیق و جداگانه پوشش خواهیم داد.
هالوژناسیون چیست؟
در این بخش، تعریف هالوژناسیون را با جزئیات بیشتری بررسی میکنیم. همانطور که در مقدمه اشاره شد، هالوژناسیون یک فرآیند شیمیایی است که طی آن، یک یا چند اتم هالوژن به یک مولکول متصل میشود. این اتمهای هالوژن از گروه ۱۷ جدول تناوبی هستند و شامل فلوئور (\(F_2\)), کلر (\(Cl_2\)), برم (\(Br_2\)) و ید (\(I_2\)) میباشند.
برای اینکه بفهمیم این واکنش چگونه کار میکند، باید بدانیم که دو راه اصلی برای اضافه کردن هالوژن به یک مولکول وجود دارد:
۱. واکنش جانشینی
تصور کنید یک اتم هیدروژن در یک مولکول مانند یک قطعه لگو در یک سازه کامل است. در واکنش جانشینی، یک اتم هالوژن میآید و جای آن قطعه لگوی هیدروژن را میگیرد و آن را از سازه خارج میکند. اسکلت اصلی مولکول دستنخورده باقی میماند. این اتفاق معمولاً برای مولکولهای اشباعشده (که پیوند دوگانه یا سهگانه ندارند) مانند آلکانها رخ میدهد.
۲. واکنش افزایشی (Addition)
حالا یک مولکول با پیوند دوگانه را تصور کنید که مانند یک سازه لگو با دو نقطه اتصال خالی است. در واکنش افزایشی، دو اتم هالوژن میآیند و به سادگی به آن دو نقطه اتصال خالی متصل میشوند، بدون اینکه قطعهای از سازه اصلی خارج شود. این واکنش پیوند دوگانه را به یک پیوند یگانه تبدیل میکند و برای مولکولهای غیراشباع مانند آلکنها اتفاق میافتد.
مقایسه واکنشپذیری هالوژنها (فلوئور، کلر، برم و ید)
همانطور که همهی ابزارها قدرت یکسانی ندارند، هالوژنها نیز در تمایلشان برای شرکت در واکنش شیمیایی با هم تفاوت دارند. درک این تفاوتها برای پیشبینی و کنترل واکنش هالوژناسیون ضروری است. ترتیب کلی واکنشپذیری این عناصر به صورت زیر است:
فلوئور > کلر > برم > ید \(F_2 > Cl_2 > Br_2 > I_2\)
این تفاوت در قدرت، به دو دلیل اصلی بازمیگردد:
۱. انرژی لازم برای شروع واکنش (انرژی پیوند)
تصور کنید هر مولکول هالوژن (\(X_2\)) یک قفل بسته است. برای شروع واکنش، ابتدا باید این قفل را باز کنیم (یعنی پیوند بین دو اتم را بشکنیم). پیوند بین دو اتم فلوئور (\(F-F\)) به طور شگفتانگیزی ضعیف و شکننده است، بنابراین این قفل به راحتی باز میشود و واکنش به سرعت آغاز میگردد.
۲. تمایل به گرفتن الکترون (الکترونگاتیویته)
پس از باز شدن قفل، هر اتم هالوژن به دنبال گرفتن الکترون از مولکول دیگر است. فلوئور در این کار از همه قویتر و مشتاقتر است (بیشترین الکترونگاتیویته را دارد). این تمایل در کلر کمی کمتر، در برم کمتر از آن، و در ید از همه کمتر است.
ترکیب این دو عامل باعث میشود که:
- فلوئوراسیون یک واکنش بسیار سریع، شدید و گاهی انفجاری باشد که کنترل آن دشوار است.
- کلریناسیون و برومیناسیون با سرعت مناسب و قابل کنترلی انجام شوند و به همین دلیل در صنعت و آزمایشگاه بسیار پرکاربرد هستند.
- یداسیون به دلیل تمایل کم ید برای واکنش، بسیار کند و اغلب نیازمند شرایط خاص برای انجام شدن است.
مکانیزمهای اصلی هالوژناسیون
در این بخش، به صورت جداگانه و با جزئیات، سه مکانیزم اصلی را که واکنشهای هالوژناسیون از طریق آنها پیش میروند، تحلیل میکنیم. هر یک از این مکانیزمها به ساختار مولکول اولیه (آلکان، آلکن یا آروماتیک) بستگی دارد و مسیر کاملاً متفاوتی را برای واکنش تعیین میکند.
مکانیزم جانشینی رادیکالی (مخصوص آلکانها)
این مکانیزم، مسیر اصلی واکنش برای هالوژناسیون آلکانها و دیگر هیدروکربنهای اشباعشده است. از آنجایی که آلکانها پیوند پای (\(\pi\)) ندارند، نمیتوانند در واکنش افزایشی شرکت کنند و به جای آن، یک اتم هیدروژن خود را با یک اتم هالوژن جایگزین میکنند. این فرآیند یک واکنش زنجیرهای است که در سه مرحله مجزا رخ میدهد:
مرحله ۱: آغاز (Initiation)
واکنش با شکستن پیوند مولکول هالوژن (\(X_2\)) شروع میشود. این پیوند به خودی خود نمیشکند و نیازمند یک منبع انرژی خارجی مانند نور فرابنفش (UV) یا حرارت بالا است. این انرژی باعث شکستهشدن همشکن (homolytic) پیوند شده و دو رادیکال هالوژن (\(X\cdot\)) بسیار واکنشپذیر ایجاد میکند. \(X_2 \xrightarrow{h\nu \text{ or } \Delta} X\cdot + X\cdot\)
مرحله ۲: انتشار (Propagation)
این مرحله یک چرخه خودکفا است که بارها و بارها تکرار میشود و محصول اصلی را تولید میکند. این چرخه شامل دو مرحله است:
- رادیکال هالوژن به یک مولکول آلکان حمله کرده و یک اتم هیدروژن از آن جدا میکند. نتیجه، تولید هیدروژن هالید (\(HX\)) و یک رادیکال آلکیل (\(R\cdot\)) است.
- رادیکال آلکیل ایجاد شده، به یک مولکول دیگر هالوژن (\(X_2\)) حمله کرده و ضمن گرفتن یک اتم هالوژن و تولید محصول نهایی (آلکیل هالید \(RX\))، یک رادیکال هالوژن جدید (\(X\cdot\)) آزاد میکند.
این رادیکال هالوژن جدید، چرخه را دوباره از مرحله ۱ تکرار میکند.
مرحله ۳: پایان (Termination)
چرخه واکنش زمانی متوقف میشود که دو رادیکال با یکدیگر برخورد کرده و یک مولکول پایدار و غیررادیکالی ایجاد کنند. این اتفاق به ندرت رخ میدهد اما در نهایت به واکنش زنجیرهای خاتمه میدهد. سه راه ممکن برای پایان وجود دارد:
- \(X\cdot + X\cdot \rightarrow X_2\)
- \(R\cdot + X\cdot \rightarrow RX\)
- \(R\cdot + R\cdot \rightarrow R-R\)
مکانیزم افزایش الکتروفیلی (مخصوص آلکنها و آلکینها)
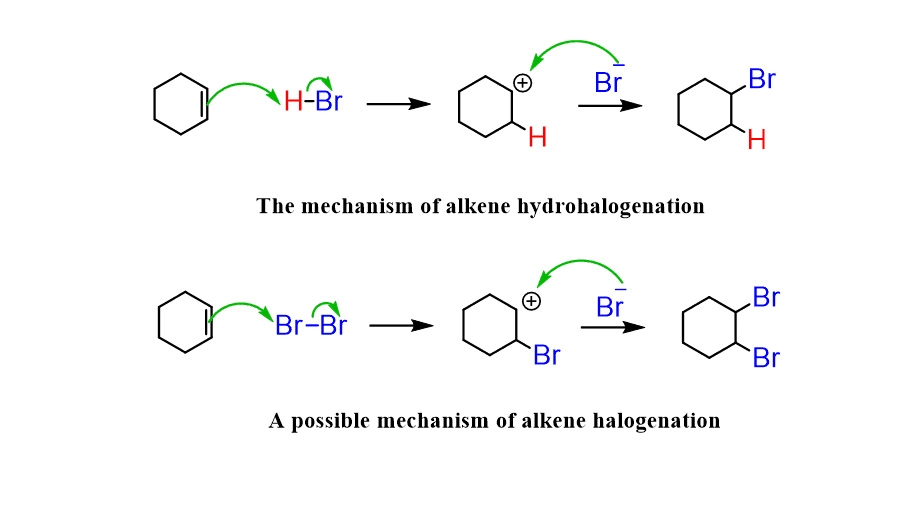
این مکانیزم مسیر اصلی واکنش برای هالوژناسیون آلکنها (دارای پیوند دوگانه) و آلکینها (دارای پیوند سهگانه) است. برخلاف آلکانها، این مولکولها غیراشباع هستند و یک ابر الکترونی غنی در پیوند پای (\(\pi\)) خود دارند. این ابر الکترونی به عنوان یک هستهدوست (Nucleophile) عمل میکند و به همین دلیل، واکنش از نوع افزایشی است، نه جانشینی.
مرحله ۱: حمله به الکتروفیل و تشکیل حد واسط
واکنش زمانی آغاز میشود که ابر الکترونی پیوند پای (\(\pi\)) به مولکول هالوژن (\(X_2\))، که به عنوان الکتروفیل (Electrophile) عمل میکند، حمله میکند. این حمله باعث شکسته شدن پیوند پای شده و یک حد واسط کاتیونی به نام یون هالونیوم حلقوی (cyclic halonium ion) ایجاد میکند. در این ساختار حلقوی، اتم هالوژن به طور همزمان به هر دو اتم کربن پیوند دوگانه متصل است.
مرحله ۲: حمله از پشت و باز شدن حلقه
در مرحله دوم، یون هالید (\(X^-\)) که در مرحله قبل ایجاد شده بود، به عنوان یک هستهدوست عمل کرده و از سمتی که کمترین ممانعت فضایی را دارد (معمولاً سمت مخالف حلقه)، به یکی از اتمهای کربن حلقه حمله میکند. این حمله باعث باز شدن حلقه و تشکیل یک محصول دیهالوژنه میشود.
این حمله از پشت، دلیل اصلی فضاگزینی (Stereoselectivity) واکنش است که به آن Anti-addition میگویند. یعنی دو اتم هالوژن از دو سمت مخالف صفحه مولکول به آن اضافه میشوند.
مثال کاربردی: واکنش پروپن با کلر
وقتی پروپن (\(CH_3-CH=CH_2\)) با کلر (\(Cl_2\)) واکنش میدهد، پیوند دوگانه شکسته شده و دو اتم کلر به کربنهای ۱ و ۲ اضافه میشوند و محصول 1,2-دیکلروپروپان را ایجاد میکنند. \(CH_3-CH=CH_2 + Cl_2 \rightarrow CH_3-CHCl-CH_2Cl\)
مکانیزم جانشینی الکتروفیلی (مخصوص ترکیبات آروماتیک)
این مکانیزم مسیر واکنش برای ترکیباتی مانند بنزن و دیگر ترکیبات آروماتیک است. برخلاف آلکنها، این مولکولها به دلیل پایداری بسیار بالای حاصل از سیستم الکترونی پای (\(\pi\)) غیرمستقر (رزونانس)، تمایلی به شرکت در واکنشهای افزایشی ندارند، زیرا این کار باعث از بین رفتن پایداری آروماتیک آنها میشود. به همین دلیل، واکنش آنها از نوع جانشینی است.
چالش واکنش: پایداری حلقه آروماتیک
ابر الکترونی حلقه بنزن، یک هستهدوست ضعیفتر از ابر الکترونی یک آلکن است. از طرف دیگر، مولکول هالوژن (\(X_2\)) نیز یک الکتروفیل ضعیف محسوب میشود. این ترکیب از یک هستهدوست ضعیف و یک الکتروفیل ضعیف، باعث میشود که واکنشی به خودی خود صورت نگیرد. برای غلبه بر این پایداری، باید الکتروفیل را بسیار قویتر کنیم.
نقش کاتالیزور اسید لوئیس: ساخت یک الکتروفیل قوی
برای انجام این واکنش، از یک کاتالیزور اسید لوئیس مانند \(FeBr_3\) (برای برومیناسیون) یا \(AlCl_3\) (برای کلریناسیون) استفاده میشود. این کاتالیزور با مولکول هالوژن واکنش داده و آن را به شدت قطبی میکند و یک الکتروفیل بسیار قوی (معادل \(X^+\)) ایجاد میکند که قدرت کافی برای حمله به حلقه پایدار بنزن را دارد. \(Br_2 + FeBr_3 \rightleftharpoons Br^+[FeBr_4]^-\)
مراحل مکانیزم
- حمله به الکتروفیل: ابر الکترونی حلقه بنزن به الکتروفیل قوی (\(Br^+\)) حمله کرده و پایداری آروماتیک خود را به طور موقت از دست میدهد. این حمله منجر به تشکیل یک حد واسط کربوکاتیونی با بار مثبت غیرمستقر میشود که به آن کمپلکس سیگما (Sigma Complex) یا یون آرنیوم میگویند.
- بازسازی آروماتیسیته: در مرحله دوم، یک باز ضعیف (معمولاً \([FeBr_4]^-\)) یک پروتون (\(H^+\)) را از کربنی که هالوژن به آن متصل شده، جدا میکند. الکترونهای پیوند \(C-H\) به داخل حلقه بازگشته، سیستم پایدار آروماتیک دوباره تشکیل میشود و محصول نهایی (آریل هالید) ایجاد میگردد. کاتالیزور نیز در این مرحله بازسازی میشود.
هالوژناسیون بر اساس نوع ترکیب آلی
در بخش قبل، به مکانیزمهای کلی واکنش پرداختیم. اکنون در این بخش، به صورت بسیار عمیقتر و با جزئیات فنی، به بررسی واکنش هالوژناسیون بر روی سه خانواده اصلی ترکیبات آلی، یعنی آلکانها، آلکنها و ترکیبات آروماتیک میپردازیم. هر یک از این دستهها به دلیل ساختار منحصر به فرد خود، رفتار کاملاً متفاوتی در برابر هالوژنها از خود نشان میدهند.
هالوژناسیون آلکانها
همانطور که اشاره شد، هالوژناسیون آلکانها از طریق مکانیزم جانشینی رادیکالی انجام میشود. در این بخش، به بررسی عمیقتر شرایط، جهتگزینی و ترمودینامیک این واکنش میپردازیم.
شرایط واکنش (نور و حرارت)
واکنش هالوژناسیون آلکانها به خودی خود آغاز نمیشود. برای شروع، به انرژی کافی برای شکستن پیوند مولکول هالوژن (\(X_2\)) و تولید رادیکالهای اولیه نیاز است. این انرژی معمولاً به یکی از دو روش زیر تأمین میشود:
- تابش نور فرابنفش (UV): که با نماد (\(h\nu\)) نمایش داده میشود.
- حرارت بالا: معمولاً دمایی بین ۲۵۰ تا ۴۰۰ درجه سانتیگراد.
در غیاب این منابع انرژی، آلکانها حتی با کلر و برم که واکنشپذیر هستند، در تاریکی و دمای اتاق واکنش نمیدهند.
جهتگزینی و پایداری رادیکالها
در آلکانهایی که بیش از یک نوع هیدروژن دارند (مانند پروپان که هیدروژنهای نوع اول و دوم دارد)، سوال این است که هالوژن کدام هیدروژن را جایگزین میکند؟ پاسخ به پایداری رادیکال آلکیل واسطه بستگی دارد. ترتیب پایداری رادیکالها به صورت زیر است:
نوع سوم > نوع دوم > نوع اول
- کلریناسیون: کلر بسیار واکنشپذیر و کمتر گزینشپذیر است. اگرچه حمله به هیدروژن نوع سوم را ترجیح میدهد، اما با تمام انواع هیدروژن واکنش داده و ترکیبی از محصولات را ایجاد میکند.
- برومیناسیون: برم به دلیل واکنشپذیری کمتر، بسیار گزینشپذیرتر است. طبق اصل هاموند (Hammond’s Postulate)، حالت گذار این واکنش شباهت بیشتری به رادیکال واسطه دارد و بنابراین برم تقریباً به طور انحصاری به هیدروژنی حمله میکند که پایدارترین رادیکال ممکن را ایجاد کند (یعنی هیدروژن نوع سوم).
تحلیل ترمودینامیکی
تفاوت در واکنشپذیری هالوژنها را میتوان با بررسی تغییرات آنتالپی (\(\Delta H\)) واکنش توضیح داد. مقادیر منفی بزرگتر نشاندهنده واکنش گرمادهتر و مطلوبتر است.
- فلوئوراسیون: بسیار گرمازا (\(\Delta H \approx -431 \text{ kJ/mol}\)) و انفجاری.
- کلریناسیون: گرمازا (\(\Delta H \approx -104 \text{ kJ/mol}\)) و مطلوب.
- برومیناسیون: کمی گرمازا (\(\Delta H \approx -29 \text{ kJ/mol}\)) و کندتر.
- یداسیون: گرماگیر (\(\Delta H \approx +55 \text{ kJ/mol}\))، نامطلوب و برگشتپذیر.
مثال کاربردی: کلرزنی صنعتی متان
در صنعت، کلرزنی متان (\(CH_4\)) برای تولید حلالهای کلردار استفاده میشود. این واکنش به سختی در مرحله اول متوقف میشود و معمولاً منجر به تولید ترکیبی از هر چهار محصول ممکن میگردد:
- کلرومتان (\(CH_3Cl\))
- دیکلرومتان (\(CH_2Cl_2\))
- تریکلرومتان (کلروفرم) (\(CHCl_3\))
- تتراکلرومتان (کربن تتراکلرید) (\(CCl_4\))
با کنترل نسبت متان به کلر (استفاده از متان اضافی)، میتوان تولید کلرومتان را افزایش داد، اما در نهایت، جداسازی این محصولات از طریق تقطیر ضروری است.
هالوژناسیون آلکنها
آلکنها به دلیل داشتن پیوندهای دوگانه (\(C=C\)), ترکیباتی غیراشباع هستند و واکنش اصلی آنها با هالوژنها از نوع افزایشی (Addition) است. در این بخش جزئیات این واکنش را بررسی میکنیم.
مکانیزم افزایش الکتروفیلی
ابر الکترونی غنی در پیوند پای (\(\pi\)) آلکن، به مولکول هالوژن (\(X_2\)) که به عنوان الکتروفیل عمل میکند، حمله میکند. این حمله منجر به تشکیل یک یون هالونیوم حلقوی به عنوان حد واسط میشود. سپس، یون هالید (\(X^-\)) از سمت مخالف به این حلقه حمله کرده و محصول نهایی دیهالوژنه را ایجاد میکند. این حمله از پشت، دلیل اصلی فضاگزینی واکنش به صورت Anti-addition است.
آزمون شیمیایی برای شناسایی آلکنها
واکنش آلکنها با محلول برم (\(Br_2\)) در تتراکلرید کربن، یک آزمون کیفی کلاسیک است. رنگ قرمز-قهوهای برم در حضور آلکن به سرعت از بین رفته و بیرنگ میشود که نشاندهنده انجام واکنش افزایشی و وجود پیوند دوگانه در ترکیب است. \(CH_2=CH_2 + Br_2 \rightarrow BrCH_2-CH_2Br\) (بیرنگ)
جهتگزینی در واکنش با هیدروژن هالیدها (قانون مارکونیکوف)
در واکنش آلکنهای نامتقارن با \(HX\), قانون مارکونیکوف جهت اتصال را تعیین میکند: اتم هیدروژن به کربنی از پیوند دوگانه متصل میشود که از ابتدا هیدروژن بیشتری داشته است. این قانون به دلیل تشکیل کربوکاتیون واسطه پایدارتر (نوع سوم > نوع دوم > نوع اول) است.
واکنش رقابتی: هالوژناسیون آلیلی
در شرایط خاص (دمای بالا یا غلظت کم هالوژن)، واکنش جانشینی در موقعیت آلیلی (کربن مجاور پیوند دوگانه) میتواند با واکنش افزایشی رقابت کند. برای انجام این واکنش به صورت هدفمند، از واکنشگرهایی مانند N-بروموسوکسینیمید (NBS) استفاده میشود که غلظت بسیار پایینی از برم را در محیط واکنش فراهم میکند.
هالوژناسیون ترکیبات آروماتیک
ترکیبات آروماتیک مانند بنزن، به دلیل پایداری بالای حلقه (رزونانس)، در واکنشهای افزایشی شرکت نمیکنند. واکنش آنها از نوع جانشینی الکتروفیلی آروماتیک (EAS) است که در آن، یک اتم هیدروژن روی حلقه با یک اتم هالوژن جایگزین میشود.
مکانیزم واکنش و نقش کاتالیزور
حلقه بنزن یک هستهدوست ضعیف است و مولکول هالوژن (\(X_2\)) نیز یک الکتروفیل ضعیف است. برای انجام واکنش، به یک کاتالیزور اسید لوئیس مانند \(FeBr_3\) یا \(AlCl_3\) نیاز است. این کاتالیزور با مولکول هالوژن واکنش داده و آن را به یک الکتروفیل بسیار قوی تبدیل میکند که قادر به حمله به حلقه بنزن است. پس از حمله، یک حد واسط به نام کمپلکس سیگما تشکیل شده و در نهایت با از دست دادن یک پروتون (\(H^+\)), پایداری آروماتیک حلقه بازسازی و محصول نهایی ایجاد میشود.
تأثیر گروههای استخلافی بر واکنش
اگر حلقه بنزن از قبل دارای یک گروه باشد، این گروه بر سرعت و محل هالوژناسیون بعدی تأثیر میگذارد:
- گروههای فعالکننده (Activating Groups): گروههایی مانند \(-OH\) یا \(-CH_3\)، حلقه را غنی از الکترون کرده و واکنش را سریعتر میکنند. این گروهها، هالوژن جدید را به موقعیتهای اورتو و پارا هدایت میکنند.
- گروههای غیرفعالکننده (Deactivating Groups): گروههایی مانند \(-NO_2\) یا \(-COOH\)، از چگالی الکترونی حلقه کاسته و واکنش را کندتر میکنند. این گروهها، هالوژن جدید را به موقعیت متا هدایت میکنند. (هالوژنها یک استثنا در این دسته هستند).
بررسی تخصصی واکنشها بر اساس نوع هالوژن
واکنشپذیری متفاوت هالوژنها که پیشتر به آن اشاره شد، باعث میشود که هرکدام شرایط، نتایج و کاربردهای منحصر به فردی در واکنشهای هالوژناسیون داشته باشند. در این بخش به بررسی ویژگیهای هر یک میپردازیم.
فلوئوراسیون (Fluorination)
فلوئور (\(F_2\)) واکنشپذیرترین هالوژن است. واکنش آن با ترکیبات آلی بسیار گرمازا (highly exothermic) و شدید بوده و اغلب به صورت انفجاری رخ میدهد. کنترل این واکنش بسیار دشوار است و به دلیل انرژی بسیار بالا، میتواند پیوندهای قوی کربن-کربن و کربن-هیدروژن را نیز بشکند و منجر به تجزیه مولکول شود. به همین دلیل، فلوئوراسیون مستقیم با \(F_2\) به ندرت استفاده میشود و نیازمند حلالهای خاص، دماهای بسیار پایین و تجهیزات ویژه برای کنترل واکنش است.
کلریناسیون (Chlorination)
کلر (\(Cl_2\)) یک هالوژن با واکنشپذیری مناسب و کنترلپذیر برای کاربردهای صنعتی است. این واکنش نسبت به فلوئوراسیون آرامتر است اما همچنان به طور قابل توجهی گرمازاست و نیازمند کنترل دما میباشد. کلریناسیون گزینشپذیری متوسطی دارد و در واکنش با آلکانها، ممکن است ترکیبی از محصولات را تولید کند. این فرآیند به طور گسترده در صنعت برای تولید حلالهای کلردار، مونومر وینیل کلراید برای ساخت PVC و فرآیندهای ضدعفونی آب استفاده میشود. (برای اطلاعات بیشتر، میتوانید به مقاله تخصصی ما در مورد «کلریناسیون چیست؟» مراجعه کنید.)
برومیناسیون (Bromination)
برم (\(Br_2\)) واکنشپذیری کمتری نسبت به کلر دارد و واکنش آن کمتر گرمازاست. مهمترین ویژگی آن، گزینشپذیری (Selectivity) بسیار بالاتر آن است. این ویژگی، برومیناسیون را به یک ابزار بسیار مفید و قابل کنترل در سنتزهای شیمیایی در آزمایشگاه و صنعت تبدیل کرده است. به عنوان مثال، در هالوژناسیون رادیکالی، برم به طور قاطع به پایدارترین موقعیت (مانند کربن نوع سوم) حمله کرده و محصولی خالصتر تولید میکند.
یداسیون (Iodination)
ید (\(I_2\)) کمترین واکنشپذیری را در بین هالوژنهای رایج دارد. واکنش یداسیون با آلکانها از نظر ترمودینامیکی نامطلوب (گرماگیر) و بسیار کند است. این واکنش معمولاً برگشتپذیر است، زیرا محصول جانبی، هیدروژن یدید (\(HI\)), یک عامل کاهنده قوی است که میتواند آلکیل یدید را دوباره به آلکان تبدیل کند. برای انجام این واکنش، معمولاً از یک عامل اکسیدکننده (مانند اسید نیتریک) استفاده میشود تا \(HI\) تولید شده را از محیط واکنش حذف کرده و تعادل را به سمت محصول پیش ببرد.
مهمترین کاربردهای صنعتی هالوژناسیون چیست؟
واکنشهای هالوژناسیون فرآیندهایی در مقیاس بزرگ هستند که منجر به تولید طیف وسیعی از محصولات اساسی در دنیای مدرن میشوند.
کاربرد هالوژناسیون در صنعت پلیمر
صنعت پلیمر به طور گسترده از ترکیبات هالوژنه به عنوان مونومر یا اصلاحکننده استفاده میکند. مهمترین مثال، تولید مونومر وینیل کلراید (VCM) از طریق فرآیندهای کلریناسیون اتیلن است. این مونومر ماده اولیه برای ساخت پلاستیک پرکاربرد پلیوینیل کلراید (PVC) محسوب میشود. همچنین، هالوژنه کردن لاستیکها (مانند تولید هالوبوتیل رابر) خواص آنها را برای کاربردهای پیشرفته بهبود میبخشد و پلیمرهای کاملاً فلوئوره شده مانند تفلون (PTFE) مقاومت حرارتی و شیمیایی بینظیری دارند.
کاربرد هالوژناسیون در داروسازی
افزودن اتمهای هالوژن به ساختار مولکولهای دارو میتواند به طور چشمگیری خواص آنها را تغییر دهد. هالوژنها میتوانند بر خصوصیاتی مانند حلالیت، پایداری متابولیکی و نحوه اتصال دارو به گیرندههای بیولوژیکی تأثیر بگذارند. به همین دلیل، تعداد بسیار زیادی از داروهای مدرن، از جمله برخی آنتیبیوتیکها (مانند کلرامفنیکل)، داروهای ضدالتهاب (مانند ایندومتاسین) و داروهای بیهوشی (مانند هالوتان)، در ساختار خود دارای یک یا چند اتم هالوژن هستند.
کاربرد در تصفیه آب و ضدعفونیکنندهها کلرزنی
رایجترین و مهمترین روش برای ضدعفونی کردن آب آشامامیدنی در سراسر جهان است. کلر به عنوان یک عامل اکسیدکننده قوی، میکروارگانیسمهای بیماریزا مانند باکتریها و ویروسها را از بین برده و به تامین آب سالم برای جوامع کمک میکند. ترکیبات مبتنی بر کلر و برم نیز به عنوان ضدعفونیکننده در استخرها و صنایع مختلف به کار میروند.
کاربرد هالوژناسیون در صنعت کشاورزی
بسیاری از ترکیبات آلی هالوژنه به دلیل فعالیت بیولوژیکی، به عنوان آفتکش در صنعت کشاورزی استفاده میشوند. این مواد شامل حشرهکشها، علفکشها و قارچکشهایی هستند که به کنترل آفات و افزایش بازده محصولات کشاورزی کمک میکنند. البته، استفاده از این ترکیبات به دلیل پایداری در محیط زیست و اثرات اکولوژیکی، تحت نظارتهای دقیق زیستمحیطی قرار دارد.
کاربرد به عنوان بازدارنده شعله
ترکیبات آلی برومدار و کلردار به طور گسترده به عنوان بازدارنده شعله در پلاستیکها، منسوجات و تجهیزات الکترونیکی استفاده میشوند. این مواد در هنگام آتشسوزی، رادیکالهای هالوژن آزاد میکنند که با رادیکالهای پرانرژی موجود در شعله واکنش داده و واکنش زنجیرهای احتراق را متوقف یا کند میکنند و به این ترتیب از گسترش آتش جلوگیری مینمایند.
ملاحظات ایمنی و زیستمحیطی هالوژناسیون
اگرچه فرآیند هالوژناسیون در صنعت بسیار مفید است، اما هم مواد اولیه (هالوژنها) و هم برخی از محصولات نهایی (ترکیبات هالوژنه) میتوانند خطرات قابل توجهی برای سلامت انسان و محیط زیست به همراه داشته باشند.
خطرات کار با هالوژنهای عنصری
هالوژنهای عنصری موادی بسیار واکنشپذیر و سمی هستند و کار با آنها نیازمند رعایت شدیدترین نکات ایمنی است.
- فلوئور (\(F_2\)): یک گاز بسیار سمی، خورنده و واکنشپذیر است که میتواند با بسیاری از مواد به صورت انفجاری واکنش دهد.
- کلر (\(Cl_2\)): یک گاز سمی و خفهکننده است که به شدت به سیستم تنفسی آسیب میزند. استفاده از آن به عنوان سلاح شیمیایی در جنگ جهانی اول، گواهی بر سمیت بالای آن است.
- برم (\(Br_2\)): یک مایع فرار و بسیار خورنده است که بخارات آن سمی بوده و تماس آن با پوست باعث سوختگیهای شیمیایی شدید میشود.
- ید (\(I_2\)): با اینکه کمخطرترین هالوژن است، اما همچنان سمی بوده و باید از تماس مستقیم یا استنشاق بخارات آن خودداری کرد.
به همین دلیل، هرگونه کار صنعتی یا آزمایشگاهی با این مواد نیازمند تهویه مناسب، تجهیزات حفاظت فردی (PPE) و پروتکلهای ایمنی سختگیرانه است.
اثرات زیستمحیطی ترکیبات آلی هالوژنه
بسیاری از ترکیبات آلی که حاوی پیوند کربن-هالوژن هستند، به دلیل پایداری بالای این پیوند، در طبیعت به راحتی تجزیه نمیشوند. این پایداری میتواند منجر به مشکلات زیستمحیطی جدی شود.
- تخریب لایه ازون: کلروفلوئوروکربنها (CFCs)، که قبلاً به طور گسترده در یخچالها و اسپریها استفاده میشدند، ترکیبات بسیار پایداری هستند. این مولکولها پس از رسیدن به استراتوسفر، تحت تأثیر اشعه UV شکسته شده و رادیکالهای کلر آزاد میکنند که به صورت زنجیرهای مولکولهای ازون (\(O_3\)) را از بین برده و باعث تخریب لایه ازون میشوند.
- آلایندههای آلی پایدار (POPs): ترکیباتی مانند DDT (یک حشرهکش) و PCBs (روغنهای صنعتی) به دلیل پایداری بالا، در محیط زیست باقی مانده و در زنجیره غذایی تجمع مییابند (Bioaccumulation). این مواد میتوانند اثرات سمی بلندمدتی بر روی حیات وحش و سلامت انسان داشته باشند.
به دلیل همین نگرانیها، امروزه تحقیقات گستردهای در حوزه «شیمی سبز» برای یافتن جایگزینهای ایمنتر یا طراحی ترکیبات هالوژنهای که به راحتی در محیط زیست تجزیه شوند، در حال انجام است.
نتیجهگیری
در این تحلیل جامع، به بررسی فرآیند هالوژناسیون به عنوان یکی از واکنشهای کلیدی در شیمی آلی پرداختیم. مکانیزمهای اصلی آن، از جانشینی رادیکالی در آلکانها تا واکنشهای الکتروفیلی در آلکنها و ترکیبات آروماتیک، به تفصیل تشریح شد.
نشان دادیم که چگونه کنترل این واکنشها، با درک تفاوت در واکنشپذیری هالوژنها و ساختار ترکیبات، منجر به تولید طیف وسیعی از محصولات حیاتی در صنایع پلیمر، دارو، کشاورزی و تصفیه آب میشود.
شناخت عمیق فرآیند هالوژناسیون، با در نظر گرفتن ملاحظات ایمنی و زیستمحیطی، یک ابزار قدرتمند برای سنتز مولکولهای جدید و بهینهسازی فرآیندهای صنعتی است.
سوالات متداول (FAQ)
در این بخش به برخی از پرسشهای کلیدی و پرتکرار در مورد فرآیند هالوژناسیون پاسخ میدهیم.
تفاوت اصلی بین هالوژناسیون آلکان و آلکن چیست؟
تفاوت اصلی در نوع واکنش و مکانیزم آن است. آلکانها (اشباعشده) تحت واکنش جانشینی رادیکالی قرار میگیرند که نیازمند انرژی (نور UV یا حرارت) است. در مقابل، آلکنها (غیراشباع) تحت واکنش افزایشی الکتروفیلی قرار میگیرند که در آن، پیوند پای (\(\pi\)) شکسته شده و هالوژن به آن اضافه میشود؛ این واکنش معمولاً به نور یا حرارت نیاز ندارد.
چرا واکنشپذیری هالوژنها (از فلوئور تا ید) متفاوت است؟
ترتیب واکنشپذیری (\(F_2 > Cl_2 > Br_2 > I_2\)) به دو عامل اصلی بستگی دارد: انرژی پیوند و الکترونگاتیویته. فلوئور به دلیل داشتن پیوند \(F-F\) ضعیف و الکترونگاتیویته بسیار بالا، واکنشپذیرترین است. با حرکت به سمت ید، انرژی پیوند تغییر کرده و الکترونگاتیویته کاهش مییابد که منجر به کاهش کلی واکنشپذیری میشود.
نقش کاتالیزور در هالوژناسیون بنزن چیست؟
حلقه بنزن به دلیل پایداری آروماتیک، به تنهایی با مولکول هالوژن (\(X_2\)) واکنش نمیدهد. یک کاتالیزور اسید لوئیس (مانند \(FeBr_3\)) با مولکول هالوژن واکنش داده و آن را به یک الکتروفیل بسیار قویتر تبدیل میکند. این الکتروفیل فعالشده، قدرت کافی برای حمله به ابر الکترونی پایدار بنزن و شروع واکنش جانشینی را دارد.