سلول گالوانی

سلول گالوانی (Galvanic Cells) که به آن سلولهای ولتایی نیز گفته میشود، نوعی سیستم الکتروشیمیایی میباشد که در آن واکنشهای خودبهخودی اکسایش-کاهش (ردوکس) در دو نیمسلول جداگانه رخ میدهد و انرژی شیمیایی به انرژی الکتریکی تبدیل میشود. این سلولها شامل دو الکترود (آند و کاتد) هستند که در محلولهای الکترولیتی قرار گرفتهاند و با یک پل نمکی به یکدیگر متصل میشوند. واکنش اکسایش در آند باعث از دست دادن الکترونها و جریان الکترونها از طریق مدار خارجی به سمت کاتد میشود، جایی که واکنش کاهش رخ میدهد. این جریان الکتریکی تولید شده میتواند برای تأمین انرژی دستگاهها یا انجام کارهای الکتریکی به کار رود.
اجزای اصلی سلول گالوانی
اجزای اصلی یک سلول گالوانی بهعنوان یک فرایند الکتروشیمیایی که واکنشهای ردوکس (اکسایش-کاهش) را به جریان الکتریکی تبدیل میکند، شامل موارد زیر است:
آند یا Anode
آند الکترودی است که در آن واکنش اکسایش رخ میدهد. در این بخش، ماده الکترونهای خود را از دست میدهد و به یون تبدیل میشود. الکترونهای آزاد شده از آند بهسمت کاتد از طریق یک مدار خارجی حرکت میکنند. آند در سلول گالوانی قطب منفی است زیرا منبع الکترونها محسوب میشود. بهطور کلی، آند جایی است که ماده الکترون از دست میدهد و اکسیده میشود.
کاتد
کاتد الکترودی است که در آن واکنش کاهش رخ میدهد. در این بخش، الکترونهای آزاد شده توسط آند از طریق مدار به کاتد میرسند و باعث کاهش یونهای موجود در محلول الکترولیت میشوند. کاتد قطب مثبت سلول است، زیرا الکترونها بهسمت آن حرکت میکنند. بهعبارت دیگر، کاتد جایی است که الکترون دریافت میشود و ماده کاهش مییابد.
الکترولیت
الکترولیت محلولی است که حاوی یونها است و در هر دو نیمسلول حضور دارد. این محلول به انتقال یونهای لازم برای انجام واکنشهای اکسایش و کاهش کمک میکند و نقش اساسی در حفظ تعادل بار الکتریکی در سلول ایفا میکند. الکترولیتها از تجمع بارها در هر نیمسلول جلوگیری میکنند و اجازه میدهند واکنشهای الکتروشیمیایی بهطور مداوم ادامه یابند.
پل نمکی
پل نمکی یا ژل الکترولیتی، لوله یا وسیلهای است که دو نیمسلول را به یکدیگر متصل میکند. وظیفه آن انتقال یونها بین دو نیمسلول است تا از ایجاد عدم تعادل بار الکتریکی جلوگیری کند. به این ترتیب، پل نمکی جریان یونها را تسهیل کرده و باعث میشود که واکنشهای الکتروشیمیایی ادامه یابند. این جزء مانع از توقف واکنشهای اکسایش و کاهش در دو نیمسلول میشود.
مدار خارجی
مدار رسانایی است که الکترونها از طریق آن از آند به کاتد منتقل میشوند. این مدار شامل سیمهای رسانا است که جریان الکتریکی را از سلول گالوانی به مصرفکننده یا دستگاههای خارجی هدایت میکند. این مدار امکان تبدیل انرژی شیمیایی به انرژی الکتریکی را فراهم میکند.
پتانسیل الکتروشیمیایی
اختلاف پتانسیل بین آند و کاتد که نیروی محرکهای برای حرکت الکترونها از آند به کاتد است. این اختلاف پتانسیل تعیینکننده میزان نیروی محرکهای است که باعث ایجاد جریان الکتریکی میشود. پتانسیل الکتروشیمیایی وابسته به نوع مواد بهکار رفته در آند و کاتد و غلظت الکترولیت است.
واکنشهای اکسایش و کاهش در سلول گالوانی
در سلولهای گالوانی واکنشهای اکسایش و کاهش بهصورت خودبهخودی رخ میدهند و منجر به تبدیل انرژی شیمیایی به انرژی الکتریکی میشوند. این واکنشها اساس کار سلول گالوانی هستند و در دو نیمسلول مجزا اتفاق میافتند. در ادامه بهطور تخصصی به این واکنشها میپردازیم:
واکنش اکسایش (Oxidation) در آند
- اکسایش فرآیندی است که طی آن یک ماده الکترونهای خود را از دست میدهد و به یونهای باردار تبدیل میشود. این فرآیند در آند رخ میدهد که در آن، ماده فلزی (یا گونه واکنشدهنده) الکترونهای خود را به مدار خارجی تحویل میدهد و به حالت یون مثبت در محلول الکترولیت در میآید. به عبارت دیگر، در آند، ماده فلزی از طریق از دست دادن الکترونها اکسید میشود. الکترونهای آزاد شده از آند به سمت کاتد از طریق یک مدار رسانا منتقل میشوند. این فرآیند آند را به قطب منفی سلول تبدیل میکند.
واکنش کاهش (Reduction) در کاتد
- کاهش فرآیندی است که طی آن یک ماده الکترونها را دریافت میکند و به حالت خنثی یا فلزی باز میگردد. این واکنش در کاتد رخ میدهد. الکترونهایی که از طریق مدار از آند منتقل شدهاند، در کاتد با یونهای مثبت موجود در الکترولیت واکنش داده و منجر به کاهش آنها به گونههای خنثی (معمولاً فلزی) میشوند. در کاتد، الکترونها جذب شده و یونهای باردار کاهش مییابند، به همین دلیل کاتد بهعنوان قطب مثبت سلول عمل میکند.
عملکرد واکنشهای اکسایش و کاهش
- در هر سلول گالوانی، واکنشهای اکسایش و کاهش بهطور مستقل و در نیمسلولهای مجزا انجام میگیرند، اما بهصورت همزمان و وابسته به یکدیگر رخ میدهند. واکنش اکسایش در آند تولید الکترونها و جریان آنها به سمت کاتد را ممکن میسازد، در حالی که واکنش کاهش در کاتد با دریافت این الکترونها تکمیل میشود.
- واکنش اکسایش در آند، الکترونهای لازم برای واکنش کاهش در کاتد را فراهم میکند. این الکترونها از طریق مدار خارجی به سمت کاتد منتقل شده و در آنجا یونهای مثبت را به حالت خنثی یا فلزی کاهش میدهند.
- جریان الکتریکی که در مدار خارجی تولید میشود، نتیجهی این واکنشهای همزمان اکسایش-کاهش است که منجر به تبدیل انرژی شیمیایی به انرژی الکتریکی میشود.
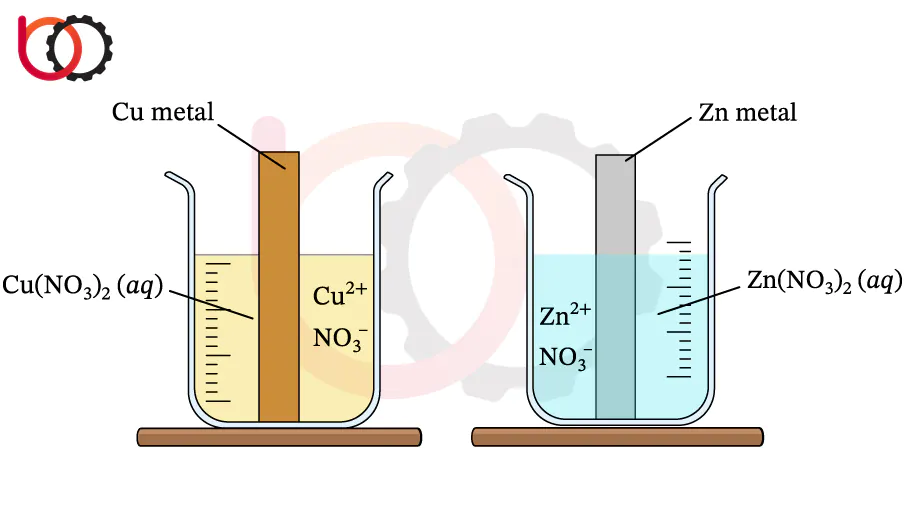
مثال ساده:
در سلول گالوانی دانیل که شامل الکترودهای روی (Zn) و مس (Cu) است، واکنشهای اکسایش و کاهش به شرح زیر رخ میدهند:
در کاتد (Cu): یونهای مس (+Cu^2) الکترونهای دریافت شده را جذب کرده و به مس فلزی خنثی تبدیل میشوند. این واکنش کاهش در کاتد رخ میدهد و مس فلزی بر سطح الکترود رسوب میکند.
در آند (Zn): روی اکسید شده و الکترونهای خود را از دست میدهد. این الکترونها از طریق مدار خارجی به کاتد منتقل میشوند، در حالی که یونهای روی (+Zn^2) وارد محلول الکترولیت میشوند.
پتانسیل الکتروشیمیایی و نیروی محرکه سلول EMF
در ادامه به بررسی پتانسیل الکتروشیمیایی و نیروی محرکه EMF میپردازیم:
پتانسیل الکتروشیمیایی
پتانسیل الکتروشیمیایی به انرژی ذخیره شده در یک سلول الکتروشیمیایی اشاره دارد که از واکنشهای شیمیایی درون سلول ایجاد میشود. این پتانسیل ترکیبی از دو مؤلفه است:
- پتانسیل شیمیایی: میل طبیعی ماده برای انجام واکنشهای شیمیایی.
- پتانسیل الکتریکی: تفاوت بار الکتریکی بین آند و کاتد که منجر به حرکت الکترونها میشود.
پتانسیل الکتروشیمیایی مشخص میکند که یک ماده تا چه حد میتواند الکترون از دست دهد یا دریافت کند و در نتیجه واکنش اکسایش یا کاهش را انجام دهد. این پتانسیل به غلظت یونها، دما، فشار و ماهیت الکترودها وابسته است.
نیروی محرکه سلول (EMF)
نیروی محرکه الکتریکی (EMF)، تفاوت پتانسیل الکتریکی بین دو الکترود (آند و کاتد) در یک سلول الکتروشیمیایی است. بهعبارت دیگر، EMF به نیرویی اشاره دارد که الکترونها را از آند به کاتد هدایت میکند و به این ترتیب جریان الکتریکی را در مدار خارجی ایجاد میکند.
این نیروی محرکه نشان میدهد که سلول چقدر قادر است جریان الکتریکی تولید کند. هرچه این اختلاف پتانسیل بیشتر باشد، جریان الکتریکی بیشتری از طریق مدار خارجی حرکت میکند و سلول کارآمدتر است.
عملکرد پتانسیل الکتروشیمیایی و EMF در سلول گالوانی
در یک سلول گالوانی، آند و کاتد هرکدام دارای یک پتانسیل الکتروشیمیایی خاص هستند. تفاوت بین این دو پتانسیل منجر به ایجاد نیروی محرکه (EMF) میشود که الکترونها را از آند به کاتد میبرد. واکنشهای شیمیایی در آند منجر به تولید الکترون میشوند که از طریق مدار خارجی به سمت کاتد حرکت میکنند و در کاتد واکنش کاهش رخ میدهد.
عوامل مؤثر بر EMF
- نوع واکنشها: بسته به نوع مواد شیمیایی و واکنشهایی که در آند و کاتد رخ میدهند، EMF سلول تغییر میکند.
- غلظت یونها: تغییر در غلظت یونها میتواند بر پتانسیل الکتروشیمیایی و در نتیجه EMF سلول تأثیر بگذارد.
- دمای سلول: افزایش یا کاهش دما نیز میتواند پتانسیل الکتروشیمیایی و نیروی محرکه سلول را تغییر دهد.
مثال ساده:
فرض کنید یک سلول گالوانی داریم که از دو فلز مختلف استفاده میکند. یکی از این فلزها (مثلاً روی) الکترون از دست میدهد و دیگری (مثلاً مس) الکترون دریافت میکند. به دلیل تفاوت در میل الکترونی این دو فلز، الکترونها از روی به مس حرکت میکنند. این تفاوت میل الکترونی همان EMF یا نیروی محرکه است که باعث جریان یافتن الکترونها میشود و در نهایت انرژی الکتریکی تولید میکند.
تفاوت بین سلول گالوانی و الکترولیتی
تفاوت بین سلولهای گالوانی و الکترولیتی از جمله مفاهیم کلیدی در شیمی الکتروشیمیایی است که نقشهای متفاوتی در تبدیل انرژی ایفا میکنند. هر دو نوع سلول به واکنشهای اکسایش و کاهش وابسته هستند، اما در نحوه تبدیل انرژی شیمیایی به الکتریکی و یا بالعکس تفاوت اساسی دارند. در ادامه، قصد داریم به بررسی دقیقتر تفاوتهای ساختاری و عملکردی این دو سلول بپردازیم تا درک بهتری از کاربردها و مکانیسمهای آنها فراهم شود.
نوع تبدیل انرژی و فرآیند الکتروشیمیایی
- سلول گالوانی (یا ولتایی): این سلول بهطور طبیعی انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند. واکنشهای شیمیایی خودبهخودی در این سلولها رخ میدهد و موجب تولید جریان الکتریکی میشود. در این حالت، انرژی آزاد شده از واکنشهای اکسایش-کاهش، مستقیماً برای تولید جریان الکتریکی استفاده میشود. این سلولها بهطور گسترده در ساخت باتریها به کار میروند.
- سلول الکترولیتی: برخلاف سلولهای گالوانی، این نوع سلولها انرژی الکتریکی را به انرژی شیمیایی تبدیل میکنند. برای این کار، جریان الکتریکی خارجی از منبع خارجی وارد سلول میشود تا واکنشهای شیمیایی غیرخودبخودی را فعال کند. این فرآیند در تولید مواد خاص مانند فلزات تصفیهشده و یا در فرآیندهای آبکاری به کار میرود.
جهت و ماهیت واکنشهای اکسایش-کاهش
- سلول گالوانی: در این سلول، واکنشهای اکسایش در آند (قطب منفی) و واکنشهای کاهش در کاتد (قطب مثبت) رخ میدهد. الکترونها از طریق یک مدار خارجی از آند به کاتد جریان پیدا میکنند. واکنشهای اکسایش-کاهش در سلول گالوانی خودبهخودی هستند، به این معنی که نیازی به انرژی خارجی برای انجام آنها نیست و جریان الکتریکی مستقیماً تولید میشود.
- سلول الکترولیتی: در اینجا آند قطب مثبت و کاتد قطب منفی است. جریان الکتریکی بهطور خارجی از منبع تغذیه وارد سلول میشود و الکترونها را وادار به حرکت در جهت مخالف جریان طبیعی سلول گالوانی میکند. در نتیجه، واکنشهای اکسایش و کاهش که بهطور خودبخودی رخ نمیدهند، با استفاده از این انرژی خارجی انجام میشوند.
کاربردهای صنعتی و تکنولوژیکی
- سلول گالوانی: این سلولها بهطور گسترده در باتریها و پیلهای سوختی استفاده میشوند. به دلیل اینکه انرژی الکتریکی بدون نیاز به منابع خارجی تولید میشود، این سلولها بهعنوان منابع انرژی در دستگاههای الکترونیکی قابلحمل، ابزارهای پزشکی و خودروهای برقی کاربرد فراوانی دارند.
- سلول الکترولیتی: این سلولها برای فرآیندهای صنعتی که نیاز به تغییرات شیمیایی دارند، مانند تصفیه فلزات (تصفیه مس، آلومینیوم و …) و آبکاری فلزات (مانند آبکاری نقره و طلا)، به کار میروند. در این نوع سلول، با استفاده از جریان الکتریکی، واکنشهای شیمیایی خاصی انجام میشود که در شرایط عادی رخ نمیدهند.
پیکربندی الکترودها
- سلول گالوانی: در سلول گالوانی، آند همان قطب منفی و کاتد قطب مثبت است. واکنش اکسایش در آند باعث آزاد شدن الکترونها میشود و این الکترونها از طریق مدار خارجی به کاتد منتقل میشوند، جایی که واکنش کاهش رخ میدهد.
- سلول الکترولیتی: در سلول الکترولیتی، نقش الکترودها معکوس میشود؛ یعنی آند قطب مثبت و کاتد قطب منفی است. جریان الکتریکی از منبع خارجی به الکترودها تحمیل میشود و واکنشهای اکسایش-کاهش بهصورت غیرخودبخودی صورت میگیرد.
سازوکار تولید جریان الکتریکی
- سلول گالوانی: در سلولهای گالوانی، جریان الکتریکی توسط واکنشهای شیمیایی طبیعی تولید میشود. این جریان الکتریکی در نتیجه تفاوت پتانسیل میان دو الکترود به وجود میآید و میتواند برای تأمین انرژی در دستگاههای مختلف استفاده شود.
- سلول الکترولیتی: در این سلولها، جریان الکتریکی باید از منبع خارجی به سیستم وارد شود تا واکنشهای شیمیایی غیرخودبخودی انجام شوند. این جریان الکتریکی فرآیندهایی نظیر الکترولیز آب برای تولید هیدروژن و اکسیژن، تصفیه فلزات، و فرآیندهای آبکاری را ممکن میسازد.
مفهوم پتانسیل استاندارد الکترود
- سلول گالوانی: در اینجا تفاوت پتانسیل الکتریکی بین دو الکترود باعث حرکت الکترونها و تولید جریان الکتریکی میشود. این تفاوت پتانسیل بر اساس میل ذاتی الکترودها به انجام واکنشهای اکسایش و کاهش تعریف میشود.
- سلول الکترولیتی: در این سلول، منبع خارجی انرژی الکتریکی برای ایجاد تفاوت پتانسیل و واداشتن الکترودها به انجام واکنشهای غیرخودبخودی، ضروری است.
سلول دانیل (Daniell Cell) و باتریهای اولیه
سلول دانیل و باتریهای اولیه از کلاسیکترین و قدیمیترین سلولهای گالوانی هستند که بهطور گسترده در مطالعات الکتروشیمی و تولید انرژی الکتریکی مورد استفاده قرار میگیرند.
سلول دانیل
سلول دانیل که توسط جان فردریک دانیل در سال 1836 ابداع شد، یک سیستم الکتروشیمیایی پایه است که بهطور مستقیم انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند. این سلول از دو نیمسلول تشکیل شده است که هرکدام شامل یک الکترود و الکترولیت مختص خود هستند.
- آند (الکترود روی): در این نیمسلول، الکترود روی (Zn) در محلول سولفات روی (ZnSO₄) قرار دارد. واکنش اکسایش در اینجا رخ میدهد؛ یعنی روی (Zn) الکترونهای خود را از دست میدهد و به یونهای روی (+Zn²) در محلول تبدیل میشود. این فرآیند باعث آزاد شدن الکترونها میشود که به مدار خارجی منتقل میشوند.
- کاتد (الکترود مس): در نیمسلول دیگر، الکترود مس (Cu) در محلول سولفات مس (CuSO₄) قرار دارد. واکنش کاهش در کاتد رخ میدهد؛ یعنی یونهای مس (+Cu²) در محلول الکترونهای آزاد شده را از مدار خارجی دریافت کرده و به مس فلزی (Cu) در سطح الکترود تبدیل میشوند.
- پل نمکی: دو نیمسلول توسط پل نمکی (salt bridge) یا دیافراگم متصل میشوند. وظیفه پل نمکی حفظ تعادل بار یونی در هر نیمسلول است، بدون آنکه محلولها با هم مخلوط شوند. این پل از یونهای مثبت و منفی برای جبران بارهای الکتریکی استفاده میکند.
- عملکرد: الکترونها از طریق مدار خارجی از آند به کاتد منتقل میشوند و در نتیجه جریان الکتریکی تولید میکنند. انرژی شیمیایی واکنشهای اکسایش و کاهش به جریان الکتریکی تبدیل میشود.
کاربرد: این سلول در اوایل قرن نوزدهم برای تلگرافها و آزمایشات الکتروشیمی مورد استفاده قرار میگرفت.
باتریهای اولیه
باتریهای اولیه (مانند باتریهای روی-کربن)، نوع دیگری از سلولهای گالوانی هستند که برای تولید برق در دستگاههای کوچک و ساده طراحی شدهاند. برخلاف باتریهای قابل شارژ (ثانویه)، باتریهای اولیه پس از تخلیه شارژ مجدداً قابل استفاده نیستند.
- آند (الکترود روی): در این باتریها، الکترود روی (Zn) بهعنوان آند عمل میکند و واکنش اکسایش در آن رخ میدهد، جایی که روی الکترونهای خود را از دست میدهد و به یونهای روی تبدیل میشود.
- کاتد (الکترود کربن): الکترود کاتد از گرافیت (کربن) تشکیل شده است و در آن واکنش کاهش رخ میدهد. یونهای مثبت در الکترولیت الکترونها را از گرافیت دریافت میکنند و به مواد کاهش مییابند.
- الکترولیت: الکترولیت معمولاً شامل خمیر کلرید آمونیوم (NH₄Cl) یا کلرید روی (ZnCl₂) است که به عبور یونها در داخل باتری کمک میکند.
- عملکرد: الکترونها از آند به کاتد از طریق مدار خارجی جریان مییابند و انرژی الکتریکی تولید میکنند. این باتریها به دلیل سادگی ساختار و هزینه پایین برای دستگاههای کوچک مانند رادیوها، چراغقوهها و دیگر دستگاههای کممصرف کاربرد دارند.
آموزش رایگان ساخت سلول گالوانی یا ولتایی
ساخت یک سلول گالوانی در آزمایشگاه، فرآیندی است که به شما امکان میدهد اصول پایهای الکتروشیمی را به صورت عملی تجربه کنید. در این بخش، به طور تخصصی و گام به گام روش ساخت رایگان یک سلول گالوانی را شرح میدهیم. این راهنما همچنین به توضیح نقش هر قسمت از سلول و چگونگی واکنشهای اکسایش و کاهش در آن میپردازد.
وسایل و مواد مورد نیاز برای ساخت سلول گالوانی
- دو الکترود فلزی: ترجیحاً از الکترودهای روی (Zn) و مس (Cu) استفاده کنید.
- دو محلول الکترولیت: محلول سولفات روی (ZnSO₄) و محلول سولفات مس (CuSO₄).
- پل نمکی (Salt Bridge): از یک لوله U شکل حاوی محلول الکترولیت مانند محلول KCl یا یک کاغذ فیلتر آغشته به محلول نمکی استفاده کنید.
- بشر: برای نگهداری محلولهای الکترولیت.
- سیمهای رسانا: برای اتصال الکترودها به ولتمتر.
- گیرههای الکترودی: برای نگهداشتن الکترودها در محلول.
- ولتمتر: برای اندازهگیری اختلاف پتانسیل الکتریکی (ولتاژ).
- کاغذ صافی یا پارچه متخلخل: در صورت نیاز به استفاده از پل نمکی ساده.
مراحل گام به گام ساخت سلول گالوانی
1. آمادهسازی الکترودها
- دو الکترود روی (Zn) و مس (Cu) را تهیه کنید. این دو فلز به ترتیب به عنوان آند و کاتد عمل میکنند.
- الکترود روی در واکنش اکسایش قرار میگیرد (آند)، و الکترود مس در واکنش کاهش (کاتد) عمل خواهد کرد.
- قبل از استفاده، مطمئن شوید که سطح الکترودها تمیز است تا واکنش به خوبی انجام شود. میتوانید از سنباده برای تمیز کردن سطح الکترودها استفاده کنید.
2. تهیه محلولهای الکترولیت
- دو عدد بشر تهیه کنید. در یکی از آنها محلول سولفات روی (ZnSO₄) بریزید و در بشر دیگر محلول سولفات مس (CuSO₄).
- محلولها باید دارای غلظت مناسب (معمولاً 1 مولار) باشند تا فرآیندهای الکتروشیمیایی به خوبی انجام شود.
3. قرار دادن الکترودها در محلولها
- الکترود روی را در بشر حاوی محلول سولفات روی (ZnSO₄) و الکترود مس را در بشر حاوی محلول سولفات مس (CuSO₄) قرار دهید.
- هر الکترود باید به طور کامل در محلول غوطهور باشد تا سطح تماس کافی برای واکنشها فراهم شود.
4. استفاده از پل نمکی (Salt Bridge)
- پل نمکی یکی از اجزای حیاتی یک سلول گالوانی است که برای تکمیل مدار و انتقال یونها بین دو نیمسلول استفاده میشود.
- میتوانید از یک لوله U شکل استفاده کنید که حاوی محلول KCl یا NaCl است. دو انتهای پل نمکی را در محلولهای هر دو بشر قرار دهید.
- این پل نمکی به حفظ تعادل بارهای الکتریکی در هر دو نیمسلول کمک میکند و مانع از تجمع بیش از حد یونهای مثبت یا منفی در هر یک از نیمسلولها میشود.
5. اتصال الکترودها به ولتمتر
- سیمهای رسانا را به هر الکترود متصل کنید. یک سیم را به آند (الکترود روی) و سیم دیگر را به کاتد (الکترود مس) وصل کنید.
- سپس سیمها را به ولتمتر متصل کنید تا بتوانید ولتاژ تولید شده توسط سلول گالوانی را اندازه بگیرید.
6. مشاهده ولتاژ تولید شده
- ولتمتر شروع به نمایش ولتاژ خواهد کرد. این ولتاژ نمایانگر اختلاف پتانسیل بین دو نیمسلول است.
- معمولاً در این نوع سلول، ولتاژی در حدود 1.1 ولت مشاهده میشود که ناشی از واکنشهای اکسایش و کاهش در دو الکترود است.
واکنشهای الکتروشیمیایی در سلول گالوانی
در آند (الکترود روی – Zn):
در این قسمت، واکنش اکسایش رخ میدهد، یعنی اتمهای روی الکترونهای خود را از دست میدهند و به یونهای مثبت تبدیل میشوند:
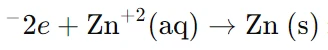
الکترونهای آزاد شده از این واکنش به سمت کاتد حرکت میکنند.
در کاتد (الکترود مس – Cu):
در این قسمت، واکنش کاهش رخ میدهد، یعنی یونهای مس که در محلول موجود هستند الکترونها را دریافت کرده و به مس فلزی تبدیل میشوند:
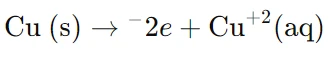
نکات مهم در ساخت سلول گالوانی
- در این فرآیند سلول گالوانی، آند همیشه جایی است که واکنش اکسایش انجام میشود و الکترود در اثر این واکنش تخریب میشود (مثلاً حل شدن الکترود روی).
- کاتد جایی است که واکنش کاهش رخ میدهد و الکترود در آن رشد میکند (افزایش جرم الکترود مس).
- ولتاژ مشاهده شده به ماهیت الکترودها، غلظت محلولها و دمای محیط بستگی دارد.