سلول الکترولیتی

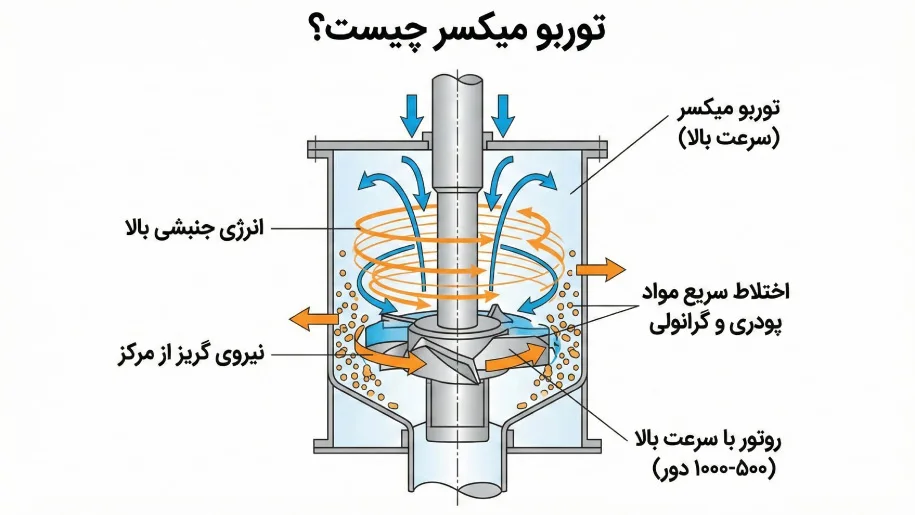
سلول الکترولیتی یک دستگاه فرایند الکتروشیمیایی است که در آن با اعمال انرژی الکتریکی از یک منبع خارجی، یک واکنش شیمیایی غیرخودبهخودی در محلول یا مذاب الکترولیت انجام میشود. در این سلول، الکترونها از طریق یک منبع خارجی به الکترودها منتقل شده و موجب جداسازی یونها در محلول میشوند. در این فرآیند، یونهای مثبت به سمت کاتد (الکترود منفی) حرکت کرده و کاهش مییابند، در حالی که یونهای منفی به سمت آند (الکترود مثبت) حرکت کرده و اکسایش را تجربه میکنند.
سلولهای الکترولیتی در فرآیندهایی همچون الکترولیز که برای تجزیه ترکیبات به عناصر سازندهشان استفاده میشود، نقش کلیدی دارند. به عنوان مثال، در فرآیند الکترولیز آب، انرژی الکتریکی برای تجزیه مولکولهای آب به گاز هیدروژن و اکسیژن مصرف میشود. همچنین، این سلولها در آبکاری فلزات، تولید فلزات خالص مانند آلومینیوم از سنگ معدن، و تصفیه فلزات کاربرد گستردهای دارند.
در سلول الکترولیتی، برخلاف سلول گالوانی که انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند، انرژی الکتریکی به انرژی شیمیایی تبدیل میشود و واکنش شیمیایی را بهصورت اجباری پیش میبرد.
ساختار و اجزای سلول الکترولیتی
سلول الکترولیتی یک دستگاه الکتروشیمیایی پیچیده است که از چندین جزء اساسی تشکیل شده و با همکاری یکدیگر فرآیندهای الکتروشیمیایی غیرخودبهخودی را تحت تأثیر اعمال جریان الکتریکی خارجی انجام میدهد. اجزای اصلی این سلول عبارتند از:
1. الکترودها (آند و کاتد)
- آند: آند در سلول الکترولیتی به قطب مثبت منبع تغذیه متصل است و مکانی است که در آن واکنش اکسایش رخ میدهد. در این الکترود، یونهای منفی (آنیونها) از طریق انتقال الکترون به آند اکسید میشوند. الکترونهای آزاد شده از آند به مدار خارجی منتقل میشوند تا جریان الکتریکی برقرار شود. جنس آند بسته به نوع واکنش و الکترولیت مورد استفاده میتواند از مواد مقاوم به خوردگی مانند گرافیت یا فلزات بیاثر باشد.
- کاتد: کاتد به قطب منفی منبع تغذیه متصل است و مکانی است که در آن واکنش کاهش رخ میدهد. در کاتد، یونهای مثبت (کاتیونها) به الکترود جذب شده و با دریافت الکترون از منبع خارجی کاهش مییابند. این واکنش باعث میشود که کاتیونها به اتمهای خنثی یا مولکولهای جدید تبدیل شوند. انتخاب مواد کاتدی نیز بسته به نوع واکنش متفاوت است؛ فلزات نجیب یا بیاثر مانند پلاتین معمولاً برای کاتد استفاده میشوند.
2. الکترولیت
- الکترولیت مادهای است که به عنوان محیط رسانای یونی عمل میکند و یونهای مثبت و منفی را بین الکترودها منتقل میکند. الکترولیت میتواند به صورت محلول آبی یا مذاب باشد و شامل یونهای فعال شیمیایی است که در واکنشهای اکسایش و کاهش شرکت میکنند. انتخاب نوع الکترولیت به واکنش مورد نظر بستگی دارد. الکترولیت میتواند اسیدی، بازی یا نمکی باشد که یونها را به شکل مطلوبی فراهم میکند و با ایجاد تعادل بین جریان یونی و الکترونیک، فرآیند الکتروشیمیایی را ممکن میسازد.
3. منبع جریان الکتریکی خارجی
- منبع تغذیه جریان مستقیم (DC) نقش کلیدی در سلول الکترولیتی ایفا میکند. این منبع انرژی الکتریکی لازم برای اجرای واکنشهای غیرخودبهخودی را تأمین میکند. در نبود این منبع، واکنشهای الکتروشیمیایی مورد نظر نمیتوانند بهطور طبیعی رخ دهند. منبع جریان الکتریکی الکترونها را از کاتد به آند از طریق مدار خارجی منتقل میکند و همزمان موجب حرکت یونهای مثبت و منفی در الکترولیت به سمت الکترودهای مخالف میشود. شدت جریان و ولتاژ منبع تعیینکننده سرعت و میزان بازدهی واکنش الکتروشیمیایی هستند.
4. ظرف واکنش (محفظه سلول)
- محفظه سلول ساختاری است که الکترودها و الکترولیت را در خود جای میدهد و از تماس مواد واکنشدهنده با محیط بیرونی جلوگیری میکند. این محفظه معمولاً از موادی ساخته میشود که نسبت به الکترولیت و واکنشهای شیمیایی مقاوم باشد تا از خوردگی و تخریب جلوگیری کند. انتخاب مواد محفظه به نوع واکنش و شرایط الکتروشیمیایی بستگی دارد. از آنجا که واکنشهای شدید الکتروشیمیایی درون سلول الکترولیتی رخ میدهد، محفظه باید از جنسهای مقاوم مانند پلیمرهای مهندسی یا فلزات مقاوم به خوردگی ساخته شود.
5. واکنشدهندهها و محصولات واکنش
- در سلول الکترولیتی، مواد واکنشدهنده شامل یونهای موجود در الکترولیت و یونهایی است که از طریق الکترودها به واکنشهای شیمیایی وارد میشوند. محصولات واکنش بسته به نوع فرآیند میتواند فلزات خالص، گازهای مختلف یا ترکیبات شیمیایی خاص باشد. این محصولات به صورت جامد، مایع یا گاز از سلول خارج میشوند و میتوانند برای استفادههای صنعتی مختلف جمعآوری شوند.
واکنشهای شیمیایی در سلول الکترولیتی
در سلول الکترولیتی، واکنشهای شیمیایی غیرخودبهخودی با اعمال انرژی الکتریکی از یک منبع خارجی رخ میدهند. این واکنشها شامل اکسایش و کاهش هستند که در الکترودهای آند و کاتد اتفاق میافتند.
واکنشهای اکسایش و کاهش در سلول الکترولیتی
- اکسایش (Oxidation): در آند (الکترود مثبت) اتفاق میافتد و شامل از دست دادن الکترونها توسط یک ماده است. در نتیجه این فرآیند، یونهای آنیون (یونهای منفی) الکترونهای خود را از دست میدهند و به اتمهای خنثی یا مواد دیگر تبدیل میشوند. واکنش اکسایش به شکل کلی به صورت زیر بیان میشود:
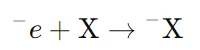
که در آن، X یک یون منفی است که الکترون خود را از دست میدهد. - کاهش (Reduction): در کاتد (الکترود منفی) رخ میدهد و شامل دریافت الکترونها توسط یک ماده است. در این فرآیند، کاتیونها (یونهای مثبت) با دریافت الکترون از منبع خارجی به مواد خنثی یا مولکولهای جدید تبدیل میشوند. واکنش کاهش به شکل کلی زیر است:
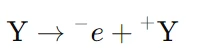
که در آن Y یک یون مثبت است که الکترون دریافت میکند.
این دو فرآیند در همکاری با هم یک مدار کامل الکتریکی را در سلول الکترولیتی تشکیل میدهند.
مثال 1: الکترولیز آب (تجزیه آب به هیدروژن و اکسیژن)
الکترولیز آب یک فرآیند الکترولیتی کلاسیک است که در آن آب (H₂O) با اعمال انرژی الکتریکی به عناصر سازندهاش یعنی هیدروژن و اکسیژن تجزیه میشود. این فرآیند در حضور یک الکترولیت مانند محلول اسیدی یا بازی قوی انجام میشود.
- در کاتد (واکنش کاهش):
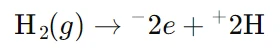
در اینجا، یونهای هیدروژن (H⁺) الکترونها را از کاتد دریافت کرده و به گاز هیدروژن (H₂) تبدیل میشوند. - در آند (واکنش اکسایش):
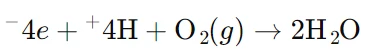
در اینجا، مولکولهای آب در آند الکترونهای خود را از دست داده و به گاز اکسیژن (O₂) و یونهای هیدروژن تبدیل میشوند. این واکنش در نهایت منجر به تولید گاز هیدروژن و اکسیژن از آب میشود که هر دو در صنایع مختلف کاربرد دارند.
مثال 2: الکترولیز کلرید سدیم (تولید سدیم و کلر)
الکترولیز کلرید سدیم مذاب (NaCl) فرآیندی است که طی آن سدیم فلزی و گاز کلر از تجزیه NaCl تولید میشوند. این فرآیند برای تولید فلز سدیم و کلر به عنوان محصولات صنعتی مهم استفاده میشود.
- در کاتد (واکنش کاهش):
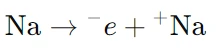
در کاتد، یونهای سدیم (Na⁺) الکترونها را دریافت کرده و به فلز سدیم تبدیل میشوند. - در آند (واکنش اکسایش):
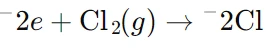
در آند، یونهای کلرید (Cl⁻) الکترونهای خود را از دست داده و به گاز کلر (Cl₂) تبدیل میشوند. این فرآیند در صنایع تولید فلز سدیم و گاز کلر برای کاربردهایی مثل تولید مواد شیمیایی مختلف، از جمله هیدروکسید سدیم (NaOH)، نقش مهمی دارد.
3. دیگر مثالهای واکنشهای الکترولیتی
- الکترولیز اکسید آلومینیوم (Al₂O₃) برای تولید فلز آلومینیوم: در این فرآیند، آلومینیوم از سنگ معدن بوکسیت استخراج میشود. در کاتد، یونهای آلومینیوم کاهش مییابند تا فلز آلومینیوم تولید شود.
- آبکاری فلزات: در آبکاری، یونهای فلز روی سطح یک جسم رسانا قرار میگیرند تا یک لایه نازک فلزی ایجاد کنند. این فرآیند در صنایع مختلف برای ایجاد لایههای محافظتی یا تزئینی استفاده میشود.
انواع سلول الکترولیتی و کاربردهای آنها
سلول الکترولیتی به انواع مختلفی تقسیم میشود که هرکدام دارای ویژگیهای ساختاری و کاربردهای صنعتی خاصی هستند. این سلولها از جمله در آبکاری فلزات، تولید کلر و سدیم هیدروکسید، تصفیه فلزات، تجزیه آب برای تولید هیدروژن و اکسیژن، و تولید آلومینیوم بهکار میروند. در ادامه، به معرفی انواع سلولهای الکترولیتی و کاربرد آنها میپردازیم:
سلولهای آبکاری
در این نوع سلولها، فلز پایه بهعنوان کاتد و فلز پوششی بهعنوان آند عمل میکند. یونهای فلز از آند آزاد شده و به سطح کاتد رسوب میکنند، که در این فرآیند، پوششی از فلز دوم بر روی سطح فلز پایه ایجاد میشود. آبکاری در بهبود خواص مکانیکی و ضد خوردگی قطعات صنعتی کاربرد دارد و برای پوششدهی فلزات ارزشمندی مانند طلا و پالادیوم در صنایع الکترونیک و جواهرسازی حیاتی است.
سلولهای کلر-قلیایی
این سلولها با استفاده از جریان الکتریکی، محلول سدیم کلرید (NaCl) را به کلر و سدیم هیدروکسید (NaOH) تجزیه میکنند. کلر تولید شده در صنایع شیمیایی و تصفیه آب، و سدیم هیدروکسید بهعنوان قلیای قوی در تولید مواد شوینده و صنایع دارویی کاربرد دارد. این فرآیند از نظر ایمنی و مدیریت پسماند به کنترل دقیق نیاز دارد.
سلول الکترولیتی تصفیه فلزات
سلولهای تصفیه فلزات برای جداسازی ناخالصیها و استخراج فلزات خالص از کانیهای معدنی بهکار میروند. در این فرآیند، فلز ناخالص بهعنوان آند و یک ورق فلز خالص بهعنوان کاتد استفاده میشود. جریان الکتریکی موجب انحلال آند و انتقال یونهای فلز به سمت کاتد میشود. این روش در تولید فلزاتی چون مس و نقره اهمیت ویژه دارد، زیرا خلوص بالا و کنترل دقیق بر ترکیب محصول نهایی را ممکن میسازد.
سلولهای تجزیه آب
این سلولها با استفاده از جریان الکتریکی، آب را به هیدروژن و اکسیژن تجزیه میکنند. هیدروژن تولید شده میتواند بهعنوان سوخت پاک در صنایع انرژیهای تجدیدپذیر استفاده شود و اکسیژن نیز در کاربردهای پزشکی و صنعتی اهمیت دارد. این فرآیند نیازمند کنترل دقیق دما و جریان الکتریکی برای بهینهسازی نرخ تولید گازها است.
سلولهای تولید آلومینیوم
فرآیند هال-هرو که در سلولهای خاص برای تولید آلومینیوم به کار میرود، با احیای الکتریکی اکسید آلومینیوم (آلومینا) در دمای بالا و با استفاده از کربن بهعنوان الکترود، فلز آلومینیوم تولید میکند. در این فرآیند، آند کربنی نقش کاهنده ایفا میکند و دماهای بالا منجر به ذوب و رسوب آلومینیوم در کاتد میشود.
کاربردهای صنعتی سلول الکترولیتی
سلول الکترولیتی بهدلیل قابلیت ایجاد واکنشهای الکتروشیمیایی در فرآیندهای مختلف صنعتی، کاربردهای گستردهای دارد که برخی از مهمترین موارد استفادهی آنها عبارتند از:
- تولید ترکیبات شیمیایی پایه: سلول الکترولیتی نقش کلیدی در تولید ترکیبات شیمیایی اصلی مانند کلر و سدیم هیدروکسید (NaOH) از طریق فرآیند کلر-قلیایی ایفا میکنند. در این فرآیند، محلول آبنمک در حضور جریان الکتریکی به یونهای کلر و سدیم تجزیه میشود. کلر بهعنوان مادهای اساسی در تولید PVC و تسمه پی وی سی، حشرهکشها و داروها استفاده میشود، و سدیم هیدروکسید نیز بهطور گسترده در تولید مواد شوینده، کاغذسازی و تصفیه آب کاربرد دارد.
- الکترولیز و تصفیه فلزات: در صنعت تصفیه فلزات، از سلول الکترولیتی برای جداسازی فلزات خالص از ناخالصیهای آنها استفاده میشود. بهعنوان مثال، در تصفیه فلز مس، آند مس ناخالص در سلول الکترولیتی حل شده و یونهای مس به سمت کاتد خالص حرکت میکنند و مس با خلوص بالا تولید میشود. این فرآیند در تصفیه فلزات گرانبها و همچنین فلزات غیرآهنی مانند نیکل و روی نیز اهمیت دارد و به دستیابی به فلزات با کیفیت بالا کمک میکند.
- آبکاری الکتروشیمیایی (Electroplating): یکی از کاربردهای مهم سلولهای الکترولیتی، آبکاری فلزات است. در این فرآیند، از سلولهای الکترولیتی برای ایجاد لایهای از فلز محافظ یا تزئینی روی سطح فلز پایه استفاده میشود. بهعنوان مثال، آبکاری با طلا یا نیکل در صنایع جواهرسازی و الکترونیک باعث افزایش مقاومت به خوردگی و بهبود زیبایی قطعات میشود. این روش در صنایع خودروسازی و تولید قطعات صنعتی نیز بهکار میرود تا دوام و مقاومت قطعات در برابر شرایط محیطی بهبود یابد.
این کاربردها، اهمیت سلول الکترولیتی در افزایش کارایی، بهبود خواص مواد و کاهش هزینههای تولید در صنایع مختلف را نشان میدهند. هر یک از این فرآیندها نیازمند کنترل دقیق دما، جریان الکتریکی و شرایط الکترولیت است تا محصولات با کیفیت بالا و کارایی مطلوب تولید شوند.
مزایا و معایب سلول الکترولیتی چیست؟
مزایای سلول الکترولیتی عبارتند از:
- بازده انرژی بالا و راندمان فرآیند: سلولهای الکترولیتی به دلیل توانایی تبدیل مستقیم انرژی الکتریکی به انرژی شیمیایی، در فرآیندهایی مانند تولید مواد شیمیایی پایه و تصفیه فلزات از بازده انرژی بالایی برخوردار هستند. این سلولها بهویژه در تولید محصولات با خلوص بالا نقش مؤثری دارند و در تولید موادی مانند کلر و هیدروکسید سدیم، بازدهی بسیار مطلوبی ارائه میدهند.
- قابلیت تنظیم دقیق پارامترهای فرآیندی: بهکارگیری سیستمهای کنترلی پیشرفته (مانند کنترل جریان، دما، و غلظت الکترولیت) امکان تنظیم دقیق فرآیند را فراهم میآورد. این سطح از کنترل، به صنایع این امکان را میدهد که ویژگیهای محصول نهایی را بهطور دقیق تنظیم کنند و تولیدات با کیفیت بالا و خصوصیات ثابت داشته باشند.
- تنوع کاربرد و گستردگی فرآیندها: سلولهای الکترولیتی در طیف گستردهای از صنایع کاربرد دارند؛ از تولید مواد شیمیایی کلیدی گرفته تا آبکاری و تصفیه فلزات. این تنوع در کاربردها، سلولهای الکترولیتی را به بخش حیاتی تولید در صنایع متعددی مانند پتروشیمی، فلزات گرانبها و صنایع الکترونیک تبدیل کرده است.
همچنین برخی از معایب سلولهای الکترولیتی عبارتند از:
- هزینههای بالای عملیاتی و مصرف انرژی: فرآیندهای الکترولیتی به دلیل نیاز به تجهیزات ویژه (مانند سیستمهای کنترل دقیق و منبع تغذیه با توان بالا)، هزینههای عملیاتی سنگینی دارند. مصرف انرژی الکتریکی در برخی کاربردها، مانند فرآیندهای تصفیه فلزات یا تولید مواد شیمیایی خاص، هزینههای بالایی ایجاد میکند که نیاز به منابع انرژی پایدار و ارزانتر احساس میشود.
- تأثیرات زیستمحیطی و پسماندهای شیمیایی مضر: سلولهای الکترولیتی میتوانند آلایندههای خطرناک و پسماندهای سمی تولید کنند، مانند گاز کلر و یونهای فلزی سنگین. این ترکیبات میتوانند اثرات مخربی بر محیط زیست داشته باشند، بنابراین مدیریت پسماند و کاهش آلایندگی از جمله نیازهای ضروری در استفاده از سلولهای الکترولیتی است. سیستمهای تصفیه و بازیافت مناسب برای کاهش اثرات منفی این آلایندهها در محیطهای صنعتی مورد نیازند.
- حساسیت به دما و محدودیت در مواد خاص: دمای بالای واکنشهای الکترولیتی ممکن است برای برخی مواد حساس به حرارت، مشکلساز باشد. این امر نیازمند کنترل دقیق دما و مدیریت حرارت در سلولهای الکترولیتی است که در غیر این صورت میتواند به تخریب یا تغییرات ساختاری مواد منجر شود و کاربرد آنها را برای برخی مواد محدود کند.
مقایسه سلولهای الکترولیتی با سلولهای گالوانی
سلولهای الکترولیتی و سلولهای گالوانی در علم الکتروشیمی، دو نوع اساسی از سلولها هستند که بهمنظور تبدیل انرژی شیمیایی و الکتریکی بهکار میروند، اما تفاوتهای مهمی در عملکرد و واکنشهای آنها وجود دارد:
ماهیت واکنش و جهت جریان الکتریکی
در سلولهای گالوانی (یا ولتایی)، واکنشهای شیمیایی بهطور طبیعی و خودبهخودی رخ داده و به ایجاد جریان الکتریکی منجر میشوند. در این سلولها، انرژی شیمیایی حاصل از واکنش اکسایش-کاهش به انرژی الکتریکی تبدیل شده و اختلاف پتانسیلی بین الکترودها ایجاد میشود. کاتد بهعنوان قطب مثبت و آند بهعنوان قطب منفی عمل میکند.
برعکس، در سلولهای الکترولیتی، واکنشهای غیرخودبهخودی بهکمک منبع انرژی الکتریکی خارجی انجام میشوند. منبع خارجی، جریان الکتریکی را از آند به کاتد هدایت میکند و این جریان انرژی الکتریکی را به انرژی شیمیایی تبدیل میسازد. در سلولهای الکترولیتی، آند قطب مثبت و کاتد قطب منفی است، که این تفاوت در قطبها نسبت به سلولهای گالوانی از ویژگیهای اصلی است.
پتانسیل الکترودها و نقش منبع خارجی
- در سلولهای گالوانی، اختلاف پتانسیل بهدلیل انرژی ذاتی واکنش اکسایش-کاهش در الکترودها ایجاد میشود. این اختلاف پتانسیل باعث میشود که جریان بهطور طبیعی از کاتد به آند برقرار شود و این ویژگی در کاربردهایی مانند باتریها، پیلهای سوختی و منابع انرژی قابلحمل اهمیت دارد.
- در سلولهای الکترولیتی، منبع الکتریکی خارجی پتانسیل لازم برای انجام واکنش را تأمین میکند. این منبع خارجی نقش کلیدی در تحریک و هدایت واکنشهای غیرخودبهخودی دارد و انرژی الکتریکی ورودی، شرایط لازم برای انجام واکنشهای خاصی مانند آبکاری یا الکترولیز آب را فراهم میآورد.
کاربردهای صنعتی و علمی
سلولهای گالوانی عمدتاً برای تولید انرژی الکتریکی استفاده میشوند. این سلولها در باتریهای متداول، باتریهای خودرو و پیلهای سوختی، که به انرژی قابلحمل و پایدار نیاز دارند، بهکار میروند و در این کاربردها انرژی شیمیایی ذخیرهشده به جریان الکتریکی تبدیل میشود.
در مقابل، سلولهای الکترولیتی به دلیل تواناییشان در انجام واکنشهای غیرخودبهخودی، در فرآیندهای صنعتی گستردهای مانند تولید کلر، تصفیه و آبکاری فلزات، و تولید هیدروژن از طریق الکترولیز آب استفاده میشوند. این سلولها نقش حیاتی در صنایع شیمیایی، تصفیه فلزات و تولید مواد با خلوص بالا دارند و در مواردی که نیاز به کنترل دقیق و تنظیم پارامترهای فرآیندی وجود دارد، مورد استفاده قرار میگیرند.
آموزش انجام آزمایش سلول الکترولیتی
در ادامه جهت درک بهتر سلول الکترولیتی به آموزش گام به گام انجام آزماش سلول الکترولیتی میپردازیم:
آمادهسازی تجهیزات و محلول الکترولیت
- ابتدا منبع تغذیه DC مناسب را انتخاب کنید که قادر به تنظیم دقیق ولتاژ و جریان باشد و میزان جریان مورد نیاز برای واکنش الکترولیتی را تأمین کند.
- الکترولیت را بر اساس واکنش انتخاب کنید. برای مثال، در الکترولیز آب از آب دیونیزه همراه با محلول رقیق اسید سولفوریک یا هیدروکسید پتاسیم برای افزایش هدایت الکتریکی استفاده میشود.
- از یک ظرف مقاوم (شیشهای یا پلاستیکی خاص مانند پلیپروپیلن) استفاده کنید که با الکترولیت و محصولات واکنش سازگار باشد و در برابر حرارت مقاوم باشد.
انتخاب و آمادهسازی الکترودها
- الکترودها باید با واکنش مورد نظر سازگار باشند. برای واکنشهای اسیدی یا آبکاری، الکترودهای پلاتینی یا کربنی بهدلیل مقاومت بالا در برابر خوردگی انتخاب مناسبی هستند.
- الکترودها را در ظرف الکترولیت و با فاصلهی مشخص نصب کنید، تا جریان بهطور یکنواخت در محلول توزیع شود و از نوسان جریان در حین انجام واکنش جلوگیری شود.
اتصال الکترودها به منبع تغذیه
- آند و کاتد را به ترمینالهای مثبت و منفی منبع تغذیه متصل کنید. دقت کنید که در سلولهای الکترولیتی، آند (قطب مثبت) واکنش اکسایش را انجام میدهد و کاتد (قطب منفی) واکنش کاهش را به عهده دارد.
- از سیمهای مقاوم و مقاوم به دما برای اتصال الکترودها استفاده کنید و از عدم تماس آنها با الکترولیت اطمینان حاصل کنید.
تنظیم پارامترهای منبع تغذیه و آغاز واکنش
- منبع تغذیه را روشن کنید و ولتاژ مورد نیاز برای شروع واکنش را تنظیم کنید. ولتاژ نباید بیش از حد باشد، زیرا میتواند موجب تولید گازهای ناخواسته و افزایش دمای محلول شود.
- در طول آزمایش، جریان را ثابت نگه دارید. برخی واکنشها نیاز به جریان خاصی دارند که باید توسط منبع تغذیه کنترل شود تا شرایط ایدهآل برای انجام واکنش ایجاد شود.
پایش و کنترل واکنش الکترولیتی
- حین انجام واکنش، پارامترهای واکنش (مانند دما، تولید گازها، و تغییرات شیمیایی در الکترودها) را پایش کنید. اگر جریان یا ولتاژ تغییر کرد، ممکن است به تنظیمات بیشتر نیاز باشد.
- در صورت تجمع رسوبات بر روی الکترودها یا افزایش دمای محلول، الکترودها را تمیز کنید یا جریان را برای مدت کوتاهی متوقف کنید.
پایان واکنش و جداسازی محصولات
- پس از رسیدن به محصول مورد نظر یا پایان واکنش، منبع تغذیه را خاموش کرده و الکترودها را از محلول خارج کنید.
- محصولات واکنش (مانند گازهای تولید شده یا رسوبات) را جمعآوری کنید. برای واکنشهایی که تولید گازهای سمی دارند، از تهویه مناسب استفاده کنید تا محیط امن بماند.
پاکسازی و دفع مواد باقیمانده
- پس از اتمام کار، ظرف و الکترودها را با دقت تمیز کنید. مواد شیمیایی باقیمانده را به درستی و طبق مقررات ایمنی محیطی دفع کنید تا از آلودگی محیط زیست جلوگیری شود.
نکات ایمنی تخصصی به هنگام انجام آزمایش سلول الکترولیتی
- همیشه از دستکش، عینک محافظ و روپوشهای مقاوم استفاده کنید.
- در صورت تولید گازهای سمی، حتماً تهویه مناسب را فراهم کنید.
- منبع تغذیه را قبل از اتمام آزمایش کاملاً خاموش کرده و اتصالات را بهدقت جدا کنید تا از هرگونه برقگرفتگی جلوگیری شود.