دی پلیمریزاسیون یا برگشت پذیری
معمولاً وقتی صحبت از مواد پلیمری میشود، ساختارهایی پایدار و مستحکم در ذهن ما شکل میگیرد که گویی برای ماندگاری طولانیمدت طراحی شدهاند. اما از دیدگاه سینتیک و ترمودینامیک شیمیایی، آیا این پایداری همیشگی است یا میتوان مسیر واکنش را تغییر داد؟ سوال اصلی اینجاست که اگر شرایط محیطی تغییر کند، آیا میتوانیم همانطور که واحدهای کوچک را به هم متصل کردیم، فرآیند را معکوس کنیم و زنجیرههای بلند را دوباره به اجزای سازنده اولیه بازگردانیم؟ این پرسش، اساس و پایه مبحث پیچیده و حیاتی دی پلیمریزاسیون است که مرز بین یک ضایعات ماندگار و یک منبع ارزشمند را تعیین میکند.
ما در این مقاله قصد داریم فرآیند دقیق و علمی برگشتپذیری یا همان دی پلیمریزاسیون را به طور کامل بررسی کنیم. هدف ما این است که با واکاوی اصول ترمودینامیکی، مکانیسمهای مولکولی شکست و روشهای متنوع صنعتی، دیدگاهی روشن و کاربردی به پژوهشگران و صنعتگران ارائه دهیم. در ادامه بررسی میکنیم که چگونه میتوان با تسلط بر دانش شیمی پلیمر، فرآیند تخریب را مهندسی کرد و از ساختارهای پلیمری مصرفشده، مجدداً مونومرهایی خالص و قابل استفاده در چرخه تولید به دست آورد.
- دی پلیمریزاسیون چیست؟
- ترمودینامیک برگشت پذیری پلیمر
- دمای سقف (Ceiling Temperature) چیست؟
- عوامل موثر بر دمای سقف و برگشت پذیری
- مکانیسم زیپی (Unzipping) در دی پلیمریزاسیون
- مکانیسم شکست تصادفی (Random Scission)
- تفاوت محصولات در مکانیسمهای مختلف شکست
- تفاوت محصولات در مکانیسمهای مختلف شکست
- روشهای حرارتی دی پلیمریزاسیون
- فرآیند هیدرولیز در دی پلیمریزاسیون(Hydrolysis)
- فرآیند گلیکولیز (Glycolysis)
- فرآیند متانولیز (Methanolysis)
- استفاده از سیالات فوق بحرانی در دی پلیمریزاسیون
- دی پلیمریزاسیون کاتالیزوری
- دی پلیمریزاسیون با امواج مایکروویو
- دی پلیمریزاسیون اولتراسونیک (فراصوت)
- بررسی دی پلیمریزاسیون در پلی استایرن (PS)
- بررسی دی پلیمریزاسیون در PMMA (پلکسی)
- بررسی دی پلیمریزاسیون در پلی اتیلن ترفتالات (PET)
- بررسی دی پلیمریزاسیون در پلی آمیدها (نایلون)
دی پلیمریزاسیون چیست؟
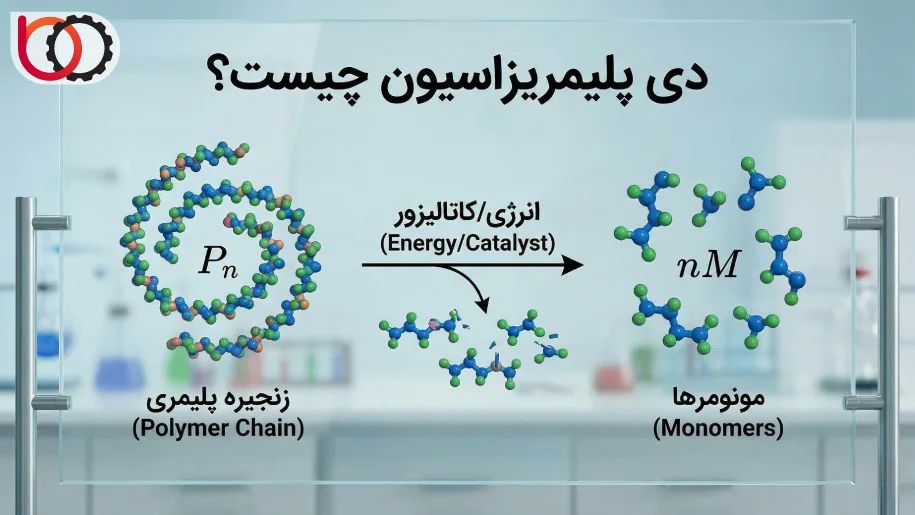
ما در علم شیمی پلیمر، دی پلیمریزاسیون (Depolymerization) را به عنوان فرآیندی تعریف میکنیم که در آن یک ماکرومولکول یا زنجیره بلند پلیمری به واحدهای سازنده اولیه خود، یعنی مونومرها یا قطعات الیگومری کوچکتر تبدیل میشود. این پدیده دقیقاً عکس واکنش پلیمریزاسیون است. اگر در پلیمریزاسیون، مولکولهای کوچک با ایجاد پیوندهای کووالانسی به یکدیگر متصل میشوند تا زنجیرهای طویل بسازند، در اینجا ما شاهد گسسته شدن این پیوندها و آزادسازی مجدد واحدها هستیم. شناخت دقیق این ماهیت برای ما اهمیت زیادی دارد، زیرا این فرآیند صرفاً یک تغییر فیزیکی مثل ذوب شدن نیست، بلکه یک تغییر شیمیایی بنیادین محسوب میشود که هویت ماده را تغییر میدهد.
تعریف فرآیند برگشت پذیری زنجیره
وقتی ما از برگشت پذیری یا Reversibility در پلیمرها صحبت میکنیم، منظورمان قابلیت سیستم برای بازگشت به حالت اولیه است. در یک واکنش دی پلیمریزاسیون کامل، زنجیره پلیمری $P_n$ که از $n$ واحد تکرار شونده تشکیل شده است، طی مراحلی پیدرپی شکسته شده و $n$ مولکول مونومر $M$ را آزاد میکند. ما میتوانیم این واکنش را به صورت کلی زیر نمایش دهیم:
$$P_n \xrightarrow{\text{Energy/Catalyst}} n M$$
این برگشت پذیری به ما اجازه میدهد که از یک ماده پلاستیکی جامد و شکلدهی شده، مجدداً به مایع یا گاز مونومر برسیم. نکته مهمی که ما باید در نظر بگیریم این است که برگشت پذیری زنجیره همیشه به صورت خودبهخودی رخ نمیدهد و معمولاً نیازمند دریافت انرژی فعالسازی یا حضور کاتالیزورهای خاص است تا پیوندهای اصلی (Main Chain Bonds) شکسته شوند.
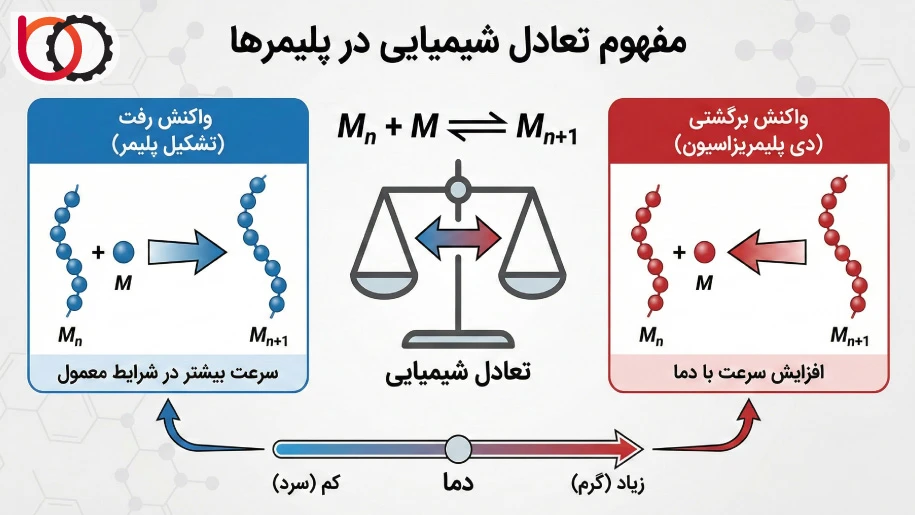
مفهوم تعادل شیمیایی در پلیمرها
درک دی پلیمریزاسیون بدون شناخت مفهوم تعادل شیمیایی (Chemical Equilibrium) ممکن نیست. ما در واکنشهای پلیمریزاسیون همیشه با یک رقابت بین واکنش رفت (تشکیل پلیمر) و واکنش برگشت (دی پلیمریزاسیون) مواجه هستیم. این تعادل را میتوانیم با معادله زیر نشان دهیم:
$$M_n + M \rightleftharpoons M_{n+1}$$
در سمت چپ، مونومر به زنجیره اضافه میشود و در سمت راست، امکان جدا شدن مونومر از زنجیره وجود دارد. ثابت تعادل این واکنش تعیین میکند که آیا سیستم به سمت ساخت پلیمر پیش میرود یا به سمت تخریب آن. ما مشاهده میکنیم که در شرایط معمول، سرعت واکنش رفت بسیار بیشتر است، اما با تغییر پارامترهایی مانند دما، سرعت واکنش برگشت افزایش مییابد تا جایی که بر سرعت پلیمریزاسیون غلبه میکند. در این نقطه، تعادل به نفع تولید مونومر جابجا میشود و ما عملاً شاهد آغاز فرآیند دی پلیمریزاسیون هستیم.
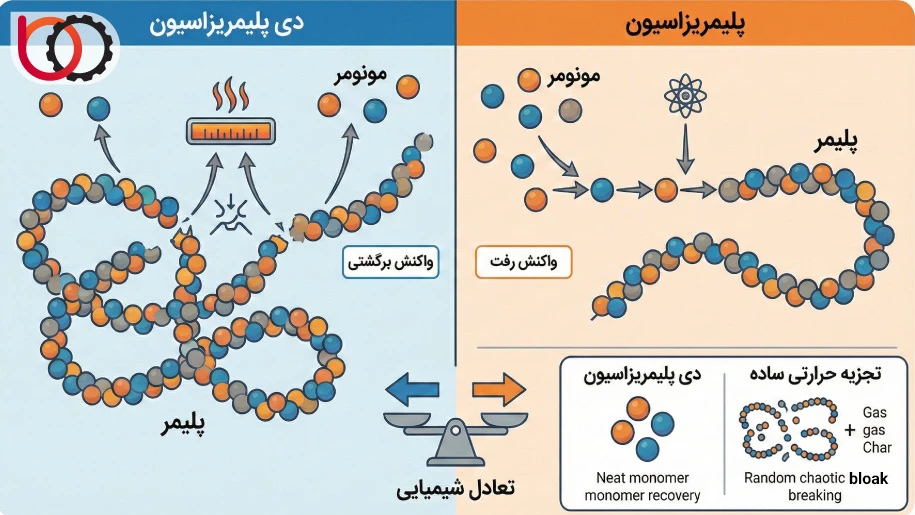
تفاوت دی پلیمریزاسیون با تجزیه حرارتی ساده
یکی از اشتباهات رایج، یکسان دانستن دی پلیمریزاسیون با تجزیه حرارتی (Thermal Decomposition) است. ما باید بین این دو مفهوم تمایز قائل شویم. دی پلیمریزاسیون یک فرآیند خاص و گزینشگر است که هدف آن بازیابی مونومر اولیه است. یعنی زنجیره پلیمری دقیقاً از نقاط اتصال بین واحدها باز میشود و محصول خروجی، همان مادهای است که در ابتدا برای ساخت پلیمر استفاده کرده بودیم. در این نوع پلیمریزاسیون که دی پلیمریزاسیون
در مقابل، تجزیه حرارتی ساده یا تخریب، یک فرآیند تصادفی و غیرقابل کنترل است. وقتی ما به پلیمر حرارت میدهیم و تجزیه حرارتی رخ میدهد، پیوندها به صورت نامنظم در نقاط مختلف میشکنند و محصول نهایی مخلوطی از گازهای مختلف، قطعات سوخته (Char) و ترکیبات هیدروکربنی بیارزش است. در دی پلیمریزاسیون ما به دنبال «بازیافت» ساختار هستیم، اما در تجزیه حرارتی ساده، ساختار معمولاً «نابود» میشود. شناخت این تفاوت برای ما در طراحی راکتورهای بازیافت بسیار حیاتی است، زیرا هدف ما رسیدن به بالاترین راندمان تولید مونومر است، نه صرفاً تبدیل جامد به گاز.
ترمودینامیک برگشت پذیری پلیمر
زمانی که به بررسی پایداری یا عدم پایداری یک ماده میپردازیم، باید اصول ترمودینامیک را به عنوان معیار اصلی قضاوت قرار دهیم. در واقع، اینکه آیا دی پلیمریزاسیون رخ میدهد یا خیر، صرفاً به دمای کوره یا نوع کاتالیزور بستگی ندارد، بلکه ریشه در موازنه انرژیهای درونی مولکول دارد. در ترمودینامیک برگشت پذیری پلیمری تلاش میکنیم تا بفهمیم نیروهای طبیعت در چه شرایطی تمایل دارند نظم زنجیره را حفظ کنند و در چه شرایطی تمایل به فروپاشی آن دارند. درک این رفتار ترمودینامیکی کمک میکند تا بتوانیم فرآیند دی پلیمریزاسیون را پیشبینی و کنترل کنیم.
نقش انرژی آزاد گیبس در واکنش معکوس
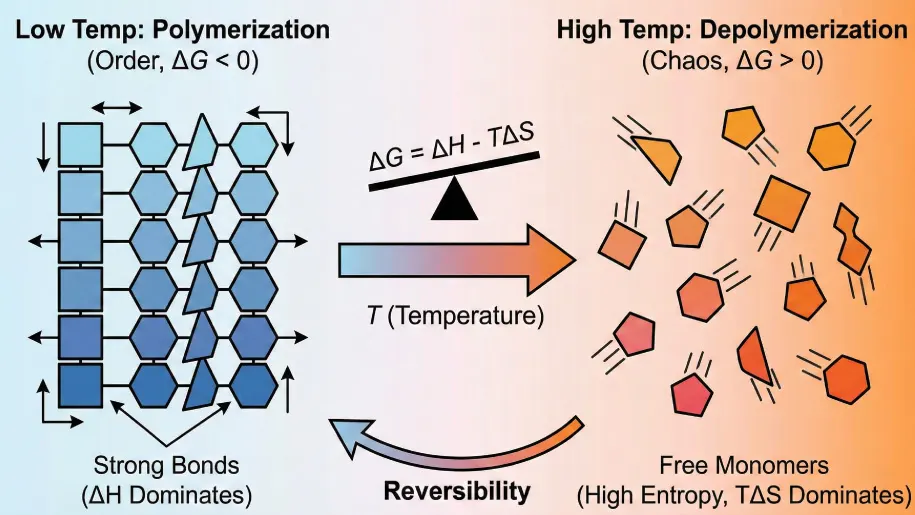
مهمترین متغیر ترمودینامیکی که جهت پیشرفت واکنش را مشخص میکند، تغییرات انرژی آزاد گیبس ($\Delta G$) است. رابطه معروف گیبس برای پلیمریزاسیون و فرآیند معکوس آن به صورت زیر تعریف میشود:
$$\Delta G_p = \Delta H_p – T \Delta S_p$$
در این معادله، $\Delta H_p$ تغییرات آنتالپی، $T$ دمای مطلق و $\Delta S_p$ تغییرات آنتروپی است. برای اینکه پلیمریزاسیون به صورت خودبهخودی انجام شود، مقدار $\Delta G$ باید منفی باشد. اما در بحث دی پلیمریزاسیون، به دنبال شرایطی هستیم که جهت واکنش تغییر کند. زمانی که دما افزایش مییابد، عبارت $-T \Delta S_p$ از نظر مقدار عددی بزرگتر میشود. از آنجا که پلیمریزاسیون معمولاً با کاهش آنتروپی همراه است (منفی بودن $\Delta S$)، عبارت $-T \Delta S$ مثبت میشود. وقتی دما از حد مشخصی بالاتر میرود، این عبارت مثبت بر آنتالپی منفی غلبه میکند و $\Delta G$ مثبت میشود. در این حالت، واکنش پلیمریزاسیون متوقف شده و دی پلیمریزاسیون یا همان برگشت پذیری پلیمری از نظر ترمودینامیکی مساعد میشود.
تاثیر آنتروپی بر شکستن زنجیره
آنتروپی ($S$) معیاری از بینظمی یا آزادی حرکت مولکولها است. میدانیم که مونومرهای آزاد در فاز مایع یا گاز، آزادی حرکت بسیار زیادی دارند و میتوانند به هر سویی حرکت کنند (آنتروپی بالا). اما وقتی این مونومرها در طی واکنش پلیمریزاسیون به هم متصل میشوند و در یک زنجیره بلند حبس میشوند، آزادی حرکت آنها به شدت محدود میشود (آنتروپی پایین).
طبیعت همیشه تمایل دارد به سمت آنتروپی بیشتر حرکت کند. در دماهای پایین، انرژی پیوندها (آنتالپی) مانع از این میشود که سیستم به سمت بینظمی برود. اما با افزایش دما، اهمیت آنتروپی در معادله گیبس چند برابر میشود. در فرآیند دی پلیمریزاسیون، نیروی محرکه اصلی همین تمایل سیستم به افزایش آنتروپی است. با شکستن زنجیره و آزاد شدن مونومرها، بینظمی سیستم به شدت زیاد میشود و این افزایش آنتروپی، موتور محرک واکنش دی پلیمریزاسیون محسوب میشود.
تاثیر آنتالپی پیوند بر پایداری
آنتالپی ($\Delta H$) در اینجا نشاندهنده گرمای واکنش و قدرت پیوندهای شیمیایی است. اکثر واکنشهای پلیمریزاسیون گرماده هستند ($\Delta H < 0$)، به این معنی که تشکیل پیوند بین مونومرها باعث آزاد شدن انرژی و ایجاد پایداری میشود. بنابراین، برای انجام دی پلیمریزاسیون که واکنشی گرماگیر است، باید انرژی لازم برای شکستن این پیوندها را تامین کنیم.
مقدار آنتالپی نشان میدهد که پیوندهای داخل زنجیره چقدر محکم هستند. هرچقدر قدرت پیوند بین مونومرها بیشتر باشد (آنتالپی منفیتر)، به انرژی حرارتی بیشتری برای غلبه بر آن نیاز داریم و فرآیند دی پلیمریزاسیون دشوارتر میشود. برای مثال، پیوندهای کربن-فلوئور در تفلون (PTFE) بسیار قوی هستند و آنتالپی تشکیل بالایی دارند، به همین دلیل برگشت پذیری پلیمری در این مواد نیازمند شرایط دمایی بسیار سختتری نسبت به پلیمرهایی مثل پلیاستایرن است که پیوندهای ضعیفتری دارند.
دمای سقف (Ceiling Temperature) چیست؟
یکی از جذابترین و مهمترین مفاهیم در شیمی فیزیک پلیمرها، مفهوم دمای سقف ($T_c$) است. این دما مرز باریکی است که تعیین میکند آیا یک مونومر میتواند به پلیمر تبدیل شود یا اینکه پلیمر موجود محکوم به فروپاشی است. در واقع، دمای سقف دمایی است که در آن فشار بخار مونومر در تعادل با زنجیرههای پلیمری قرار دارد. شناخت این دما برای کنترل فرآیند دی پلیمریزاسیون حیاتی است، زیرا به ما میگوید دقیقاً در چه نقطهای گرمایش را تنظیم کنیم تا واکنش معکوس آغاز شود. اگر دمای محیط واکنش از این حد فراتر رود، پلیمریزاسیون عملاً غیرممکن شده و واکنش به سمت تولید مونومر پیش میرود.
تعریف نقطه تعادل Tc
از دیدگاه سینتیکی، در هر واکنش پلیمریزاسیونی دو فرآیند همزمان در حال وقوع هستند: رشد زنجیره (Propagation) و شکست زنجیره (Depolymerization). در دماهای پایین، سرعت رشد زنجیره بسیار بیشتر از سرعت شکست آن است، بنابراین پلیمر تشکیل میشود. با افزایش دما، سرعت واکنش دی پلیمریزاسیون به شدت افزایش مییابد تا جایی که به سرعت رشد میرسد.
نقطه تعادل $T_c$ دقیقاً همان دمایی است که در آن سرعت پلیمریزاسیون ($R_p$) با سرعت دی پلیمریزاسیون ($R_d$) برابر میشود. در این نقطه، هیچ تغییر خالصی در طول زنجیرههای پلیمری مشاهده نمیکنیم، زیرا به همان سرعتی که مونومرها به انتهای زنجیره متصل میشوند، از آن جدا میگردند. برای بسیاری از پلیمرهای متداول مانند پلیاستایرن یا پلیمتیلمتاکریلات، دانستن این نقطه به مهندسان کمک میکند تا شرایط عملیاتی راکتورها را برای بازیافت یا تولید تنظیم کنند.
فرمول محاسبه دمای سقف
برای به دست آوردن مقدار دقیق دمای سقف، مجدداً به اصول ترمودینامیک و رابطه انرژی آزاد گیبس باز میگردیم. میدانیم که در حالت تعادل، تغییرات انرژی آزاد گیبس برابر با صفر است ($\Delta G = 0$). با قرار دادن این مقدار در معادله گیبس، میتوانیم دمای سقف را محاسبه کنیم:
$$\Delta G = \Delta H – T_c \Delta S = 0$$
با بازآرایی این معادله، فرمول نهایی دمای سقف به دست میآید:
$$T_c = \frac{\Delta H}{\Delta S}$$
در این رابطه، $\Delta H$ تغییرات آنتالپی پلیمریزاسیون و $\Delta S$ تغییرات آنتروپی پلیمریزاسیون است. از آنجایی که غلظت مونومر بر میزان آنتروپی تاثیرگذار است، دمای سقف برای یک مونومر خالص با دمای سقف همان مونومر در حالت محلول متفاوت خواهد بود. این فرمول نشان میدهد که هرچه پیوندهای تشکیل شده گرمای بیشتری آزاد کرده باشند (آنتالپی منفیتر)، دمای سقف بالاتر خواهد بود و پلیمر در برابر دی پلیمریزاسیون مقاومتر است.
چرا بالای دمای سقف پلیمر تشکیل نمیشود؟
زمانی که دما از $T_c$ عبور میکند، شرایط ترمودینامیکی کاملاً دگرگون میشود. در دماهای بالاتر از $T_c$، عبارت آنتروپی ($T\Delta S$) چنان بزرگ میشود که بر آنتالپی غلبه کرده و موجب مثبت شدن $\Delta G$ برای واکنش پلیمریزاسیون میگردد. همانطور که میدانیم، واکنش با انرژی آزاد گیبس مثبت، خودبهخودی نیست.
بنابراین، اگر تلاش کنیم در دمایی بالاتر از دمای سقف، مونومرها را وادار به پلیمریزاسیون کنیم، واکنش پیش نمیرود. و برعکس، اگر یک پلیمرِ از پیش ساخته شده را به دمایی بالاتر از $T_c$ برسانیم، سیستم برای رسیدن به پایداری ترمودینامیکی، به سمت افزایش آنتروپی حرکت میکند. این یعنی زنجیرهها ناپایدار شده و فرآیند برگشت پذیری پلیمری یا دی پلیمریزاسیون به صورت خودبهخودی و سریع رخ میدهد تا زمانی که تمام پلیمر به مونومر تبدیل شود یا غلظت مونومر در محیط به حدی برسد که تعادل جدیدی برقرار گردد.
عوامل موثر بر دمای سقف و برگشت پذیری
در بخش قبل فرمول کلی دمای سقف را بررسی کردیم، اما در عمل، این دما یک عدد ثابت و تغییرناپذیر برای هر پلیمر نیست. پارامترهای محیطی و ساختاری متعددی وجود دارند که میتوانند این نقطه تعادل را تغییر دهند. برای مهندسان شیمی و طراحان فرآیند بازیافت، شناخت این عوامل ابزاری قدرتمند است؛ زیرا با دستکاری این متغیرها میتوانند شرایط را به نفع پلیمریزاسیون یا برعکس، به نفع دی پلیمریزاسیون تغییر دهند. در واقع، هنر کنترل واکنشهای برگشت پذیری پلیمری در مدیریت همین متغیرها نهفته است.
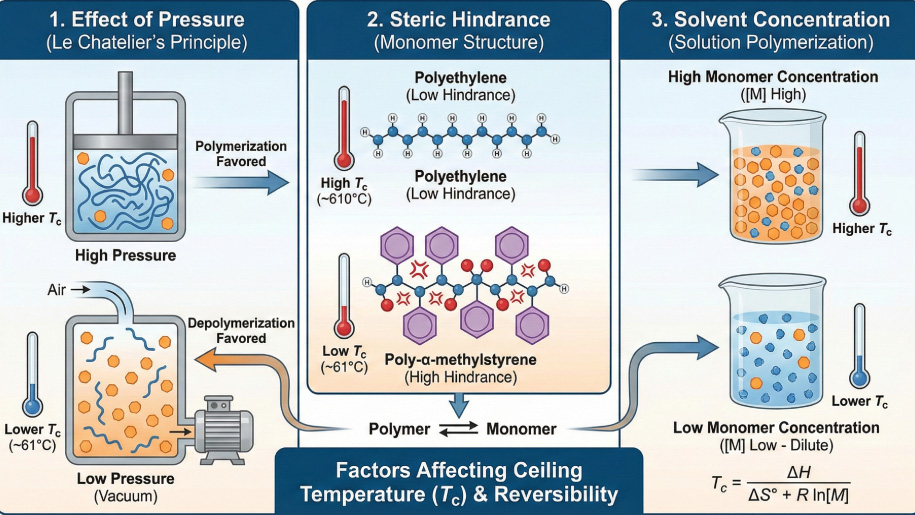
اثر فشار محیط بر جابجایی تعادل
طبق اصل لوشاتلیه، سیستمهای شیمیایی همیشه در برابر تغییرات اعمال شده مقاومت میکنند تا به تعادل جدید برسند. در اکثر واکنشهای پلیمریزاسیون، حجم نهایی پلیمر کمتر از حجم مجموع مونومرها است (تراکم حجم). بنابراین، افزایش فشار محیط باعث میشود سیستم به سمت تولید پلیمر (سمت با حجم کمتر) متمایل شود و این یعنی افزایش فشار، دمای سقف را بالا میبرد.
برعکس این موضوع برای ما در صنعت بازیافت جذابیت دارد. کاهش فشار (ایجاد خلاء) باعث میشود تعادل به سمت افزایش حجم، یعنی تولید گاز مونومر جابجا شود. به همین دلیل است که در بسیاری از روشهای صنعتی دی پلیمریزاسیون، از سیستمهای تحت خلاء استفاده میشود. با کاهش فشار، دمای سقف پلیمر کاهش مییابد و میتوانیم در دماهای پایینتر و با مصرف انرژی کمتر، فرآیند برگشت پذیری پلیمری را با راندمان بالا اجرا کنیم.
نقش ساختار فضایی مونومر (ممانعت فضایی)
ساختار شیمیایی خود مونومر تاثیر چشمگیری بر پایداری حرارتی پلیمر دارد. وجود گروههای حجیم جانبی روی زنجیره اصلی باعث ایجاد پدیدهای به نام «ممانعت فضایی» (Steric Hindrance) میشود. وقتی گروههای بزرگ در کنار هم قرار میگیرند، نیروی دافعه بین آنها باعث ایجاد تنش در ساختار پلیمر میشود. این تنش داخلی باعث میشود که پیوندها ناپایدارتر شده و آنتالپی تشکیل ($\Delta H$) کمتر منفی باشد.
به عنوان مثال، در پلیاتیلن که تنها اتمهای کوچک هیدروژن روی زنجیره دارد، دمای سقف بسیار بالا (حدود ۶۱۰ درجه سانتیگراد) است و دی پلیمریزاسیون خالص آن دشوار است. اما در پلیمری مانند پلی-آلفا-متیلاستایرن، حضور همزمان گروه فنیل و گروه متیل روی یک کربن، ازدحام فضایی زیادی ایجاد میکند. این فشار داخلی باعث میشود دمای سقف به شدت افت کند (حدود ۶۱ درجه سانتیگراد) و این پلیمر استعداد بسیار بالایی برای دی پلیمریزاسیون و تبدیل شدن به مونومر اولیه داشته باشد.
تاثیر حلال در پلیمریزاسیون محلولی
اگر واکنش پلیمریزاسیون یا تخریب در محیط محلول (حلال) انجام شود، غلظت مونومر ($[M]$) به یک عامل تعیینکننده تبدیل میشود. در سیستمهای محلولی، رابطه دمای سقف به صورت زیر اصلاح میگردد:
$$T_c = \frac{\Delta H}{\Delta S^\circ + R \ln [M]}$$
در این رابطه مشاهده میکنیم که $T_c$ وابستگی لگاریتمی به غلظت مونومر دارد. هرچقدر محیط رقیقتر باشد (غلظت مونومر کمتر)، عبارت مخرج کسر بزرگتر شده و در نتیجه دمای سقف کاهش مییابد. این بدین معناست که رقیق کردن محیط واکنش با حلال، به فرآیند دی پلیمریزاسیون کمک میکند. این نکته در بازیافت شیمیایی برخی پلیمرها اهمیت دارد، جایی که استفاده از حلال مناسب میتواند دمای لازم برای شکستن زنجیرهها را کاهش داده و کنترل فرآیند را سادهتر کند.
مکانیسم زیپی (Unzipping) در دی پلیمریزاسیون
در دنیای واکنشهای پلیمری، همه شکستها یکسان نیستند. یکی از دقیقترین و «مهندسیشدهترین» روشهای شکست مولکولی که منجر به تولید مونومر خالص میشود، مکانیسم باز شدن از انتها یا همان «زیپی» (Unzipping) است. همانطور که از نام آن پیداست، این فرآیند شباهت زیادی به باز کردن زیپ یک لباس دارد؛ زنجیره پلیمری نه از وسط، بلکه دقیقاً از آخرین نقطه اتصال شروع به باز شدن میکند و واحدها یکی پس از دیگری جدا میشوند. این مکانیسم اصلیترین مسیر برای دستیابی به دی پلیمریزاسیون با بازدهی بالا است و در بسیاری از پلیمرهای صنعتی مهم رخ میدهد.
شروع واکنش از انتهای زنجیره
در مکانیسم زیپی، نقطه آغازین واکنش اهمیت حیاتی دارد. برخلاف تخریبهای حرارتی معمول که گرما به هر نقطهای از زنجیره حمله میکند، در اینجا واکنش معمولاً از «انتهای زنجیره» (Chain End) شروع میشود. انتهای زنجیرههای پلیمری معمولاً نقاطی فعال یا ضعیفتر نسبت به بدنه اصلی هستند. این نقاط ممکن است گروههای عاملی خاص یا رادیکالهای به دام افتاده از زمان پلیمریزاسیون باشند.
زمانی که انرژی حرارتی یا کاتالیزوری به سیستم اعمال میشود، این انتهای زنجیره فعال شده و یک مرکز رادیکالی آزاد تولید میکند. این رادیکال انتهایی، ناپایدار است و تمایل دارد به وضعیت پایدارتری برسد. در واقع، استارت فرآیند برگشت پذیری پلیمری در این مکانیسم، با فعال شدن همین تک نقطه در انتهای ماکرومولکول زده میشود و بقیه زنجیره تا آن لحظه دست نخورده باقی میماند.
بازگشت دانه به دانه به مونومر
پس از شکلگیری رادیکال فعال در انتهای زنجیره، فرآیند اصلی آغاز میشود. در این مرحله، رادیکال انتهایی باعث گسست پیوند بتا (Beta-scission) میشود. این شکست دقیقاً آخرین واحد مونومر متصل به زنجیره را جدا و آزاد میکند. نکته جالب توجه اینجاست که پس از جدا شدن اولین مونومر، رادیکال از بین نمیرود، بلکه به واحد قبلی منتقل میشود.
این انتقال رادیکال باعث میشود که انتهای جدید زنجیره دوباره فعال شود و مونومر بعدی را جدا کند. این چرخه با سرعت بسیار زیادی تکرار میشود: فعال شدن انتها، جدا شدن مونومر، انتقال رادیکال به عقب. این واکنش زنجیرهای تا زمانی که کل زنجیره پلیمری مصرف شود یا رادیکال به نحوی غیرفعال گردد، ادامه مییابد. در نتیجه، مشاهده میکنیم که یک زنجیره بلند پلیمری، بدون اینکه به قطعات رندوم و نامشخص تبدیل شود، به صورت منظم و دانه به دانه به مونومرهای سازندهاش تبدیل میگردد.
راندمان تولید مونومر خالص در روش زیپی
اهمیت صنعتی مکانیسم زیپی در خلوص محصول نهایی آن است. در صنایعی که هدف بازیافت شیمیایی (Chemical Recycling) است، همیشه ترجیح میدهیم که مکانیسم زیپی رخ دهد. چرا؟ زیرا در این روش، محصول جانبی، دایمر، تریمر یا قطعات سوخته به حداقل میرسد و خروجی راکتور عمدتاً (گاهی تا بیش از ۹۵ درصد) مونومر خالص است.
پلیمرهایی مانند پلیمتیلمتاکریلات (PMMA) یا پلیتترافلوئورواتیلن (PTFE) نمونههای کلاسیک این رفتار هستند. در این مواد، ساختار شیمیایی به گونهای است که پس از تشکیل رادیکال، مسیر ترمودینامیکی ترجیحی، جدا شدن مونومر است و نه واکنشهای جانبی دیگر. بنابراین، اگر هدف ما در یک پروژه دی پلیمریزاسیون دستیابی به مواد اولیهای باشد که بتوان مجدداً آنها را پلیمریزه کرد و به محصولی با کیفیت «نو» تبدیل نمود، باید شرایط فرآیند (دما، فشار، کاتالیزور) را طوری تنظیم کنیم که مکانیسم زیپی بر سایر مکانیسمهای تخریب غالب شود.
مکانیسم شکست تصادفی (Random Scission)
در مقابل مکانیسم زیپی که رفتاری منظم و قابل پیشبینی دارد، ما با مکانیسم شکست تصادفی مواجه هستیم. همانطور که از نام آن پیداست، در این روش هیچ اولویتی برای شکستن پیوندها از انتهای زنجیره وجود ندارد. انرژی حرارتی یا تابشی به کل ساختار پلیمر وارد میشود و هر پیوند در طول زنجیره اصلی، پتانسیل برابری برای شکستن دارد. این نوع از دی پلیمریزاسیون معمولاً در پلیمرهایی رخ میدهد که اتم هیدروژنِ روی کربنِ آلفا دارند (مانند پلیاتیلن) و انتقال رادیکال به بدنه زنجیره در آنها راحتتر از جدا شدن مونومر انتهایی است.
گسست پیوندها از نقاط میانی زنجیره
در شکست تصادفی، حمله به زنجیره پلیمری شبیه به بریدن یک طناب بلند با قیچی به صورت تصادفی در نقاط مختلف است. وقتی انرژی فعالسازی تأمین میشود، پیوندهای کووالانسی کربن-کربن (C-C) در هر نقطهای از اسکلت اصلی مولکول ممکن است بشکنند. این اتفاق باعث میشود که یک ماکرومولکول بسیار بزرگ ناگهان به دو تکه ماکرومولکول کوچکتر تقسیم شود.
تفاوت اصلی اینجاست که در اینجا برای شروع واکنش نیازی به «انتها» نداریم. واکنش میتواند دقیقاً از وسط زنجیره آغاز شود. این ویژگی باعث میشود که سرعت تخریب ساختار فیزیکی پلیمر بسیار بالا باشد، حتی اگر هنوز هیچ مونومری تولید نشده باشد. در واقع، در مراحل اولیه این نوع دی پلیمریزاسیون، تعداد شکستها نسبت به کل پیوندها اندک است، اما تأثیر آنها بر طول زنجیره بسیار چشمگیر است.
تولید مخلوطی از الیگومرها و دیمرها
برخلاف مکانیسم زیپی که محصول خروجی آن عمدتاً مونومر خالص است، خروجی مکانیسم شکست تصادفی شبیه به یک سوپ مولکولی ناهمگن است. وقتی زنجیرهها از نقاط مختلف خرد میشوند، قطعاتی با طولهای کاملاً متفاوت ایجاد میگردند. در خروجی راکتور، ما شاهد طیف وسیعی از محصولات هستیم: از دیمرها (دو واحدی) و تریمرها (سه واحدی) گرفته تا الیگومرهای سنگینتر و تنها مقدار کمی مونومر.
این تنوع در محصولات، چالش بزرگی در بحث برگشت پذیری پلیمری ایجاد میکند. اگر هدف ما تولید مونومر خالص برای پلیمریزاسیون مجدد باشد، شکست تصادفی به تنهایی کافی نیست و نیاز به مراحل جداسازی و تصفیه پیچیدهای دارد. با این حال، در برخی روشهای بازیافت که هدف تولید سوخت مایع یا واکسهای صنعتی است، تولید این مخلوط الیگومری دقیقاً همان چیزی است که به دنبال آن هستیم.
کاهش سریع ویسکوزیته و وزن مولکولی
یکی از شاخصهای مهم برای تشخیص نوع مکانیسم دی پلیمریزاسیون در آزمایشگاه، بررسی تغییرات ویسکوزیته (گرانروی) و وزن مولکولی در طول زمان است. در مکانیسم زیپی، چون زنجیرهها دانه دانه از بین میروند، وزن مولکولی زنجیرههای باقیمانده تقریباً ثابت میماند (فقط تعدادشان کم میشود). اما در شکست تصادفی، وضعیت کاملاً معکوس است.
تنها چند شکست در نقاط میانی یک زنجیره با وزن مولکولی بالا، کافی است تا وزن مولکولی متوسط به شدت سقوط کند. این کاهش وزن مولکولی باعث افت شدید و ناگهانی ویسکوزیته مذاب پلیمر میشود. مشاهده میکنیم که پلیمر جامد و چقرمه، خیلی سریع به مایعی رقیق و روان تبدیل میگردد، حتی قبل از اینکه مقدار قابل توجهی گاز یا مونومر تبخیر شده باشد. این رفتار رئولوژیکی نشانه بارز غلبه مکانیسم شکست تصادفی در فرآیند است.
تفاوت محصولات در مکانیسمهای مختلف شکست
شناخت مکانیسم واکنش به تنهایی کافی نیست؛ آنچه برای مهندسان فرآیند و سرمایهگذاران اهمیت دارد، محصولی است که در انتهای خط تولید از راکتور صنعتی خارج میشود. بسته به اینکه زنجیره پلیمری از چه مسیری دچار دی پلیمریزاسیون شود، خروجی میتواند یک ماده باارزش و خالص (مونومر) یا ترکیبی درهم از مواد مختلف (مخلوط هیدروکربنی) باشد. در این بخش تحلیل میکنیم که ساختار پلیمر و شرایط عملیاتی چگونه دیکته میکنند که محصول نهایی چه باشد.
چه زمانی مونومر خالص تولید میشود؟
تولید مونومر خالص، هدف نهایی و ایدهآل در بازیافت شیمیایی است تا بتوانیم چرخه «پلیمر به پلیمر» را تکمیل کنیم. مونومر خالص عمدتاً زمانی تولید میشود که مکانیسم «زیپی» (Unzipping) بر فرآیند حاکم باشد. این اتفاق معمولاً در پلیمرهایی رخ میدهد که ساختار شیمیایی آنها اجازه انتقال رادیکال به بدنه زنجیره را نمیدهد.
به طور خاص، پلیمرهایی که در آنها کربنِ آلفا (کربنی که گروه جانبی به آن متصل است) فاقد اتم هیدروژن است، مستعدترین کاندیداها برای این حالت هستند. نمونه بارز آن پلیمتیلمتاکریلات (PMMA) است. در این ساختار، وجود گروههای متیل و استر مانع از واکنشهای جانبی میشود و رادیکال تنها یک راه فرار دارد: جدا کردن مونومر. در چنین شرایطی، بازدهی تبدیل پلیمر به مونومر میتواند به بیش از ۹۵ درصد برسد که برای برگشت پذیری پلیمری بسیار مطلوب است. همچنین، انجام واکنش در خلاء با خارج کردن سریع مونومر از محیط واکنش، تعادل را به سمت تولید بیشتر مونومر خالص پیش میبرد.
چه زمانی مخلوطی از الیگومرها حاصل میشود؟
در بسیاری از موارد، هدف ما تولید سوخت یا روغنهای صنعتی است و نیاز به خلوص بالای مونومر نداریم؛ یا اینکه ساختار پلیمر اصلاً اجازه تولید مونومر خالص را نمیدهد. وقتی پلیمری مثل پلیاتیلن (PE) یا پلیپروپیلن (PP) را تحت حرارت قرار میدهیم، به دلیل وجود اتمهای هیدروژنِ قابل دسترس روی زنجیره، رادیکالها مدام از انتهای زنجیره به وسط زنجیره میپرند (انتقال هیدروژن درون مولکولی یا بین مولکولی).
این جابجایی رادیکال باعث فعال شدن مکانیسم «شکست تصادفی» میشود. نتیجه این است که به جای دانههای یکدست مونومر، تکههایی با طولهای مختلف از زنجیره جدا میشوند. محصول نهایی در این حالت مخلوطی پیچیده از دیمرها، تریمرها، واکسها و الیگومرهای سنگین است. در صنعت، این مخلوط معمولاً به عنوان خوراک برای واحدهای کراکینگ بخار یا به عنوان سوختهای هیدروکربنی استفاده میشود، زیرا جداسازی تکتک اجزای آن از نظر اقتصادی مقرونبهصرفه نیست.
تاثیر دما بر انتخاب نوع مکانیسم شکست
دما همانند یک کلید تنظیمکننده عمل میکند که میتواند کفه ترازو را بین تولید مونومر و تولید الیگومر جابجا کند. اصول ترمودینامیک به ما میگویند که با افزایش دما، آنتروپی سیستم تمایل به بیشینه شدن دارد. بیشترین آنتروپی زمانی حاصل میشود که ما بیشترین تعداد مولکول گازی کوچک (مونومر) را داشته باشیم. بنابراین، به صورت تئوری، افزایش دما باید دی پلیمریزاسیون به سمت مونومر را تشدید کند.
اما در عمل، قضیه کمی پیچیدهتر است. اگر دما بیش از حد بالا رود، انرژی جنبشی مولکولها چنان زیاد میشود که پیوندها نه تنها به روش زیپی، بلکه به صورت تصادفی نیز شروع به شکستن میکنند. به عبارت دیگر، دمای خیلی بالا ممکن است درصد تبدیل را زیاد کند، اما گزینشپذیری (Selectivity) را کاهش میدهد و منجر به تولید محصولات جانبی ناخواسته و حتی کربنیزه شدن (تولید زغال) میشود. هنر مهندسی فرآیند در این است که «پنجره دمایی» مناسبی را پیدا کنیم که در آن، انرژی برای شکستن پیوندها کافی باشد، اما آنقدر زیاد نباشد که کنترل مکانیسم از دست خارج شود.
تفاوت محصولات در مکانیسمهای مختلف شکست
شناخت مکانیسم واکنش به تنهایی کافی نیست؛ آنچه برای مهندسان فرآیند و سرمایهگذاران اهمیت دارد، محصولی است که در انتهای خط تولید از راکتور خارج میشود. بسته به اینکه زنجیره پلیمری از چه مسیری دچار دی پلیمریزاسیون شود، خروجی میتواند یک ماده باارزش و خالص (مونومر) یا ترکیبی درهم از مواد مختلف (مخلوط هیدروکربنی) باشد. در این بخش تحلیل میکنیم که ساختار پلیمر و شرایط عملیاتی چگونه دیکته میکنند که محصول نهایی چه باشد.
چه زمانی مونومر خالص تولید میشود؟
تولید مونومر خالص، هدف نهایی و ایدهآل در بازیافت شیمیایی است تا بتوانیم چرخه «پلیمر به پلیمر» را تکمیل کنیم. مونومر خالص عمدتاً زمانی تولید میشود که مکانیسم «زیپی» (Unzipping) بر فرآیند حاکم باشد. این اتفاق معمولاً در پلیمرهایی رخ میدهد که ساختار شیمیایی آنها اجازه انتقال رادیکال به بدنه زنجیره را نمیدهد.
به طور خاص، پلیمرهایی که در آنها کربنِ آلفا (کربنی که گروه جانبی به آن متصل است) فاقد اتم هیدروژن است، مستعدترین کاندیداها برای این حالت هستند. نمونه بارز آن پلیمتیلمتاکریلات (PMMA) است. در این ساختار، وجود گروههای متیل و استر مانع از واکنشهای جانبی میشود و رادیکال تنها یک راه فرار دارد: جدا کردن مونومر. در چنین شرایطی، بازدهی تبدیل پلیمر به مونومر میتواند به بیش از ۹۵ درصد برسد که برای برگشت پذیری پلیمری بسیار مطلوب است. همچنین، انجام واکنش در خلاء با خارج کردن سریع مونومر از محیط واکنش، تعادل را به سمت تولید بیشتر مونومر خالص پیش میبرد.
چه زمانی مخلوطی از الیگومرها حاصل میشود؟
در بسیاری از موارد، هدف ما تولید سوخت یا روغنهای صنعتی است و نیاز به خلوص بالای مونومر نداریم؛ یا اینکه ساختار پلیمر اصلاً اجازه تولید مونومر خالص را نمیدهد. وقتی پلیمری مثل پلیاتیلن (PE) یا پلیپروپیلن (PP) را تحت حرارت قرار میدهیم، به دلیل وجود اتمهای هیدروژنِ قابل دسترس روی زنجیره، رادیکالها مدام از انتهای زنجیره به وسط زنجیره میپرند (انتقال هیدروژن درون مولکولی یا بین مولکولی).
این جابجایی رادیکال باعث فعال شدن مکانیسم «شکست تصادفی» میشود. نتیجه این است که به جای دانههای یکدست مونومر، تکههایی با طولهای مختلف از زنجیره جدا میشوند. محصول نهایی در این حالت مخلوطی پیچیده از دیمرها، تریمرها، واکسها و الیگومرهای سنگین است. در صنعت، این مخلوط معمولاً به عنوان خوراک برای واحدهای کراکینگ بخار یا به عنوان سوختهای هیدروکربنی استفاده میشود، زیرا جداسازی تکتک اجزای آن از نظر اقتصادی مقرونبهصرفه نیست.
تاثیر دما بر انتخاب نوع مکانیسم شکست
دما همانند یک کلید تنظیمکننده عمل میکند که میتواند کفه ترازو را بین تولید مونومر و تولید الیگومر جابجا کند. اصول ترمودینامیک به ما میگویند که با افزایش دما، آنتروپی سیستم تمایل به بیشینه شدن دارد. بیشترین آنتروپی زمانی حاصل میشود که ما بیشترین تعداد مولکول گازی کوچک (مونومر) را داشته باشیم. بنابراین، به صورت تئوری، افزایش دما باید دی پلیمریزاسیون به سمت مونومر را تشدید کند.
اما در عمل، قضیه کمی پیچیدهتر است. اگر دما بیش از حد بالا رود، انرژی جنبشی مولکولها چنان زیاد میشود که پیوندها نه تنها به روش زیپی، بلکه به صورت تصادفی نیز شروع به شکستن میکنند. به عبارت دیگر، دمای خیلی بالا ممکن است درصد تبدیل را زیاد کند، اما گزینشپذیری (Selectivity) را کاهش میدهد و منجر به تولید محصولات جانبی ناخواسته و حتی کربنیزه شدن (تولید زغال) میشود. هنر مهندسی فرآیند در این است که «پنجره دمایی» مناسبی را پیدا کنیم که در آن، انرژی برای شکستن پیوندها کافی باشد، اما آنقدر زیاد نباشد که کنترل مکانیسم از دست خارج شود.
روشهای حرارتی دی پلیمریزاسیون
در مقیاس صنعتی، متداولترین و در دسترسترین روش برای شکستن ساختارهای پلیمری، استفاده از انرژی حرارتی است. در روشهای حرارتی دی پلیمریزاسیون، ما با اعمال گرمای کنترلشده، انرژی لازم برای غلبه بر انرژی فعالسازی پیوندها را فراهم میکنیم. این روشها به دلیل عدم نیاز به حلالهای شیمیایی گرانقیمت و قابلیت اجرا برای طیف وسیعی از ضایعات پلیمری مخلوط، جایگاه ویژهای در صنعت بازیافت دارند. البته چالش اصلی در اینجا، مدیریت دقیق انتقال حرارت است تا محصول نهایی کیفیت خود را حفظ کند و دچار سوختگی نشود.
اصول فرآیند پیرولیز (Pyrolysis)
پیرولیز یا گرماکافت، فرآیندی است که در آن تخریب شیمیایی مواد آلی در اثر گرما و در «غیاب اکسیژن» انجام میشود. حذف اکسیژن در این فرآیند حیاتی است؛ زیرا حضور اکسیژن منجر به احتراق و تولید دیاکسید کربن و خاکستر میشود، در حالی که هدف ما در برگشت پذیری پلیمری، بازیابی هیدروکربنها است.
در یک راکتور پیرولیز استاندارد، دما معمولاً بین ۴۰۰ تا ۸۰۰ درجه سانتیگراد تنظیم میشود. در این بازه دمایی، ارتعاشات مولکولی به حدی میرسد که پیوندهای کربن-کربن توانایی تحمل آن را ندارند و شروع به گسستن میکنند. محصولات خروجی پیرولیز معمولاً به سه فاز تقسیم میشوند: فاز گاز (شامل متان، هیدروژن و مونومرهای سبک)، فاز مایع (شامل روغنهای پیرولیزی، واکس و آروماتیکها) و فاز جامد (شامل باقیماندههای کربنی یا Char). نسبت این سه فاز مستقیماً به دما، نرخ گرمایش و زمان اقامت مواد در راکتور بستگی دارد.
پیرولیز در خلاء (Vacuum Pyrolysis)
یکی از تکنیکهای پیشرفته برای افزایش راندمان و خلوص محصولات، انجام فرآیند پیرولیز تحت فشار کاهشیافته یا خلاء است. همانطور که در بخش ترمودینامیک اشاره کردیم، کاهش فشار باعث کاهش دمای جوش و تسهیل خروج بخارات میشود. در پیرولیز در خلاء، فشار عملیاتی راکتور به مقادیر بسیار پایین (گاهی کمتر از ۱۵ کیلوپاسکال) رسانده میشود.
این افت فشار دو مزیت بزرگ ایجاد میکند. اولاً، دمای مورد نیاز برای دی پلیمریزاسیون کاهش مییابد که به معنای صرفهجویی در مصرف انرژی است. ثانیاً، و مهمتر از آن، مولکولهای تبخیر شده به سرعت از ناحیه داغ راکتور تخلیه میشوند. این خروج سریع مانع از وقوع واکنشهای ثانویه نامطلوب میشود. اگر بخارات مدت زیادی در محیط داغ بمانند، ممکن است دوباره بشکنند و به گازهای سبک بیارزش تبدیل شوند. بنابراین، پیرولیز در خلاء روشی کارآمد برای به حداکثر رساندن تولید مایعات نفتی و مونومرهای سنگینتر است.
تکنولوژی بستر سیال برای انتقال حرارت
پلیمرها ذاتاً عایق حرارتی هستند و انتقال گرما به عمق تودههای پلاستیکی یکی از چالشهای فنی اصلی است. اگر حرارت به صورت یکنواخت توزیع نشود، لایههای بیرونی میسوزند در حالی که لایههای داخلی هنوز سرد هستند. برای حل این مشکل، تکنولوژی راکتورهای بستر سیال (Fluidized Bed) توسعه یافته است.
در این سیستم، جریانی از گاز داغ از پایین به بستری از ذرات جامد (مانند شن کوارتز یا کاتالیزور) دمیده میشود و آنها را به حالت معلق درمیآورد. ذرات پلیمری آسیاب شده به داخل این بستر داغ و متلاطم تزریق میشوند. تماس مداوم و شدید بین شنهای داغ و ذرات پلیمر باعث انتقال حرارت فوقالعاده سریع و یکنواخت میشود. این انتقال حرارت موثر باعث میشود که دی پلیمریزاسیون در زمانی بسیار کوتاه و با دمایی کاملاً کنترلشده رخ دهد که نتیجه آن افزایش بازدهی و یکنواختی محصول خروجی است.
فرآیند هیدرولیز در دی پلیمریزاسیون(Hydrolysis)
هیدرولیز یا آبکافت، یکی از روشهای بنیادین در شیمی است که در آن از مولکول آب برای شکستن پیوندهای کووالانسی استفاده میشود. در مبحث دی پلیمریزاسیون، این روش جایگاه ویژهای دارد، اما به دلیل گستردگی و پیچیدگیهای فنی آن، ما در یک مقاله مستقل و تخصصی تحت عنوان «هیدرولیز چیست و چه کاربردی دارد» به تفصیل به آن پرداختهایم. در اینجا صرفاً به بررسی نقش آن در برگشت پذیری پلیمری و کلیات فرآیند بسنده میکنیم تا دیدگاهی کلی از این روش داشته باشید.
شکستن پیوند استری یا آمیدی با آب
مکانیزم هیدرولیز دقیقاً عکس واکنش تراکمی است. در این فرآیند، مولکول آب به پیوندهای استری (در PET) یا آمیدی (در نایلون) حمله کرده و زنجیره را قطع میکند. محصول این برش، بازیابی گروههای عاملی اسیدی و الکلی/آمینی اولیه است. این روش برای پلیمرهای جاذب رطوبت و دارای گروههای قطبی بسیار کارآمد است و مسیر مستقیمی برای تبدیل ضایعات به مونومر فراهم میکند.
شرایط هیدرولیز اسیدی و بازی
برای انجام واکنش در زمان صنعتی، آب به تنهایی کافی نیست و نیاز به کاتالیزور داریم. فرآیند میتواند در محیط اسیدی (با اسیدهای قوی) یا محیط بازی (با سود) انجام شود. هرکدام از این روشها سینتیک و محصولات جانبی متفاوتی دارند که انتخاب آنها به نوع پلاستیک و خلوص مورد نیاز بستگی دارد. (جزئیات کامل واکنشهای اسیدی و بازی در مقاله تخصصی هیدرولیز بررسی شده است).
مدیریت پساب در هیدرولیز
چالش اصلی این روش، تولید حجم بالای پساب مایع است. پس از جداسازی مونومر، آب باقیمانده باید تصفیه شود تا استانداردهای زیستمحیطی را پاس کند. مدیریت این چرخه آب و تصفیه نمکهای حاصله، نکته کلیدی در اقتصادی بودن هیدرولیز است.
فرآیند گلیکولیز (Glycolysis)
در بین روشهای شیمیایی دی پلیمریزاسیون، گلیکولیز (Glycolysis) جایگاه ویژهای دارد، به خصوص در صنعت بازیافت پلیاتیلن ترفتالات (PET). در این روش، ما به جای آب، از یک دیال (الکل دو عاملی) مانند اتیلن گلیکول برای شکستن زنجیرههای پلیمری استفاده میکنیم. مزیت اصلی گلیکولیز نسبت به هیدرولیز این است که واکنش در فشار اتمسفر و دمای نسبتاً ملایمتری قابل انجام است و مشکل خوردگی شدید تجهیزات (که در هیدرولیز اسیدی داشتیم) در اینجا وجود ندارد. این روش در حال حاضر یکی از اصلیترین گزینهها برای تبدیل ضایعات پلاستیکی به مواد اولیه با ارزش افزوده بالا محسوب میشود.
تبادل استری با اتیلن گلیکول
مکانیسم شیمیایی حاکم بر گلیکولیز، واکنش «تبادل استری» (Transesterification) است. در این فرآیند، مولکول اتیلن گلیکول به پیوندهای استری موجود در زنجیره پلیمری حمله میکند. تصور کنید زنجیره پلیمری یک رشته طولانی از اتصالات استری است؛ مولکولهای کوچک گلیکول وارد این زنجیره شده و جایگزین الکل اصلی متصل به اسید میشوند.
نتیجه این جایگزینی، خرد شدن زنجیره بلند پلیمر به قطعات کوچکتر است. اگر واکنش به طور کامل پیش برود، هر واحد پلیمری توسط مولکولهای گلیکول محاصره شده و از زنجیره جدا میشود. این روش برگشت پذیری پلیمری بسیار کارآمد است، زیرا حلال مصرفی (اتیلن گلیکول) خود یکی از اجزای سازنده اصلی پلیمر PET است و ورود آن به سیستم ناخالصی شیمیایی ناشناختهای ایجاد نمیکند.
تولید بیس (2-هیدروکسی اتیل) ترفتالات (BHET)
هدف نهایی و محصول طلایی در فرآیند گلیکولیز PET، مادهای به نام بیس (2-هیدروکسی اتیل) ترفتالات یا به اختصار BHET است. برخلاف هیدرولیز که مستقیماً اسید ترفتالیک (TPA) میدهد، گلیکولیز مونومری را تولید میکند که آماده پلیمریزاسیون مجدد است. BHET یک پودر سفید کریستالی است که میتواند مستقیماً در خط تولید پلیمر وارد شده و با حذف گلیکول اضافی، دوباره به PET تبدیل شود.
دستیابی به BHET خالص چالش اصلی مهندسان فرآیند است. اگر واکنش کامل نباشد، به جای مونومر BHET، مخلوطی از دیمرها و الیگومرهای کوتاه زنجیر تولید میشود. بنابراین، بهینهسازی زمان واکنش و نسبت حلال به پلیمر برای ما حیاتی است تا تعادل واکنش به سمت تولید حداکثری مونومر BHET پیش برود و از تشکیل محصولات جانبی جلوگیری شود.
کاربرد کاتالیزورهای استات روی در گلیکولیز
واکنش تبادل استری بدون حضور کاتالیزور بسیار کند است و ساعتها به طول میانجامد. برای افزایش سرعت دی پلیمریزاسیون، از کاتالیزورهای فلزی استفاده میکنیم. یکی از متداولترین و مؤثرترین این کاتالیزورها، استات روی (Zinc Acetate) است.
این نمک فلزی به عنوان یک اسید لوئیس عمل میکند و با فعال کردن گروه کربونیل در زنجیره پلیمر، آن را مستعد حمله مولکولهای گلیکول میسازد. تحقیقات نشان دادهاند که استات روی تعادل خوبی بین سرعت واکنش و خلوص محصول ایجاد میکند. البته کاتالیزورهای دیگری مانند استات منگنز، تیتانیوم بوکسید و مایعات یونی نیز مورد بررسی قرار گرفتهاند، اما استات روی به دلیل قیمت مناسب و کارایی بالا، همچنان در مقیاس صنعتی محبوبیت دارد. جداسازی این کاتالیزور از محصول نهایی (BHET) در مرحله تصفیه بسیار مهم است تا محصول بازیافتی شفاف و بدون کدورت باشد.
فرآیند متانولیز (Methanolysis)
متانولیز یکی دیگر از روشهای پیشرفته در دسته واکنشهای حلالکافت است که در آن از متانول به عنوان عامل شکست زنجیره استفاده میشود. این روش در تاریخچه بازیافت شیمیایی جایگاه ویژهای دارد، زیرا یکی از اولین روشهای صنعتی برای بازگرداندن پلیاتیلن ترفتالات (PET) به چرخه تولید بود. در فرآیند دی پلیمریزاسیون به روش متانولیز، هدف ما شکستن کامل ساختار پلیمر و تبدیل آن به مواد اولیه پایه است. برخلاف گلیکولیز که محصولی نیمه پلیمریزه (BHET) میدهد، متانولیز ساختار را تا سطح استرهای ساده خرد میکند.
واکنش پلیمر با متانول در فشار بالا
یکی از تفاوتهای اساسی متانولیز با سایر روشها، شرایط سختگیرانه عملیاتی آن است. متانول یک حلال با نقطه جوش پایین (حدود ۶۵ درجه سانتیگراد) و فراریت بسیار بالا است. برای اینکه بتوانیم انرژی فعالسازی لازم برای شکستن پیوندهای پلیمری را فراهم کنیم، نیاز به دماهای بالا (معمولاً بین ۱۸۰ تا ۲۸۰ درجه سانتیگراد) داریم.
در این دما، متانول به شدت تمایل به تبخیر دارد. بنابراین، برای نگه داشتن متانول در فاز مایع و در تماس با پلیمر، ناچاریم واکنش را در فشارهای بالا (معمولاً ۲۰ تا ۴۰ بار) و در راکتورهای اتوکلاو انجام دهیم. این فشار بالا باعث نفوذ عمیق مولکولهای کوچک متانول به درون ماتریس پلیمری میشود و سرعت برگشت پذیری پلیمری را به شدت افزایش میدهد. طراحی راکتورهایی که بتوانند این فشار را تحمل کنند و ایمنی فرآیند را تضمین نمایند، از چالشهای مهندسی این روش است.
تولید دی متیل ترفتالات (DMT)
محصول اصلی و شاخص فرآیند متانولیز، مادهای به نام دیمتیل ترفتالات (Dimethyl Terephthalate) یا به اختصار DMT است. واکنش کلی به صورت زیر نمایش داده میشود:
$$PET + 2CH_3OH \rightarrow DMT + EG$$
در این واکنش، هر واحد تکرار شونده در پلیمر با دو مولکول متانول واکنش میدهد. خروجی راکتور شامل مخلوطی از DMT، اتیلن گلیکول (EG) و متانول اضافی است. DMT در دمای محیط جامد است و قابلیت کریستالیزه شدن دارد. تولید این ماده برای صنایعی که هنوز از تکنولوژیهای قدیمیتر پلیمریزاسیون بر پایه DMT استفاده میکنند، بسیار ارزشمند است. همچنین، میتوان DMT را طی یک مرحله هیدرولیز بعدی به اسید ترفتالیک خالص (PTA) تبدیل کرد.
مزیت متانولیز در خالص سازی
شاید بپرسید با وجود فشار بالا و خطرات کار با متانول، چرا هنوز از این روش استفاده میشود؟ پاسخ در «قدرت خالصسازی» فوقالعاده آن نهفته است. در فرآیند دی پلیمریزاسیون ضایعات بسیار آلوده یا رنگی، متانولیز برتری محسوسی دارد.
از آنجا که محصول نهایی (DMT) قابلیت تقطیر و تبلور مجدد را دارد، میتوان ناخالصیها، رنگها و افزودنیهای مزاحم را با راندمان بسیار بالا از آن جدا کرد. در روشهایی مثل گلیکولیز، جدا کردن برخی ناخالصیها از محصول BHET دشوار است، اما در متانولیز، ما میتوانیم محصولی به دست آوریم که از نظر کیفیت شیمیایی دقیقاً مشابه ماده نو (Virgin) است. این ویژگی باعث میشود متانولیز گزینهای ایدهآل برای بازیافت بطریهای رنگی و ظروف بستهبندی پیچیده باشد که سایر روشها در تصفیه آنها ناتوان هستند.
استفاده از سیالات فوق بحرانی در دی پلیمریزاسیون
در روشهای معمول شیمیایی که بررسی کردیم، همیشه با محدودیتهای انتقال جرم و نفوذ حلال به داخل ساختار جامد پلیمر مواجه هستیم. اما اگر بتوانیم حلالی داشته باشیم که نفوذپذیری گازها و قدرت حلالیت مایعات را همزمان داشته باشد، چه اتفاقی میافتد؟ اینجاست که تکنولوژی سیالات فوق بحرانی (Supercritical Fluids) وارد میدان میشود.
ما در این روش، دما و فشار حلال را به بالاتر از «نقطه بحرانی» آن میرسانیم. در این ناحیه فازی، مرز بین مایع و گاز از بین میرود و سیال خواص منحصربهفردی پیدا میکند. استفاده از این تکنولوژی در دی پلیمریزاسیون، زمان واکنش را از ساعتها به دقیقهها کاهش میدهد و نیاز به کاتالیزورهای شیمیایی اضافی را حذف میکند که گامی بزرگ در جهت «شیمی سبز» محسوب میشود.
ویژگیهای آب فوق بحرانی
آب در شرایط عادی (دما و فشار محیط) یک حلال قطبی است و نمیتواند پلیمرهای آلی غیرقطبی را در خود حل کند. اما وقتی دمای آب را به بالای ۳۷۴ درجه سانتیگراد و فشار را به بالای ۲۲.۱ مگاپاسکال میرسانیم، رفتار آن کاملاً دگرگون میشود. در حالت آب فوق بحرانی (SCW)، پیوندهای هیدروژنی تضعیف شده و ثابت دیالکتریک آب به شدت کاهش مییابد.
در این شرایط، آب رفتاری شبیه به حلالهای آلی پیدا میکند و میتواند زنجیرههای پلیمری را در خود حل کند. این پدیده باعث میشود که آب و پلیمر تشکیل یک فاز همگن بدهند. در این محیط تکفازی، مولکولهای آب با انرژی بالا مستقیماً به پیوندهای هیدرولیزپذیر حمله میکنند. نتیجه این است که دی پلیمریزاسیون و شکست پیوندها با سرعتی باورنکردنی و بدون نیاز به افزودن اسید یا باز انجام میشود و مشکل خوردگی و خنثیسازی پساب که در روشهای سنتی داشتیم، حذف میگردد.
ویژگیهای متانول فوق بحرانی
متانول نیز همانند آب میتواند به حالت فوق بحرانی برسد، اما با شرایطی ملایمتر. نقطه بحرانی متانول در دمای ۲۳۹ درجه سانتیگراد و فشار ۸.۱ مگاپاسکال قرار دارد. پایینتر بودن این نقطه نسبت به آب، باعث میشود که رسیدن به شرایط عملیاتی در صنعت ایمنتر و کمهزینهتر باشد.
در حالت متانول فوق بحرانی، ویسکوزیته سیال به شدت پایین میآید و ضریب نفوذ آن افزایش مییابد. این ویژگی به متانول اجازه میدهد تا به سرعت در ماتریسهای پلیمری فشرده (مانند بطریهای PET بازیافتی) نفوذ کند. در این روش، متانول هم نقش حلال و هم نقش واکنشگر را بازی میکند. تحقیقات ما نشان میدهد که در این شرایط، برگشت پذیری پلیمری با راندمان بسیار بالا رخ میدهد و محصولاتی مانند DMT با خلوص بالا تولید میشوند که پس از سرد شدن و کاهش فشار، به راحتی از متانول جدا میگردند.
سرعت واکنش در فاز فوق بحرانی
مهمترین مزیت رقابتی استفاده از سیالات فوق بحرانی، بحث «سینتیک واکنش» است. در روشهای معمول هیدرولیز یا گلیکولیز، فرآیند دی پلیمریزاسیون کامل ممکن است بین ۴ تا ۸ ساعت زمان ببرد. این زمان طولانی به معنای مصرف انرژی مداوم و کاهش ظرفیت تولید راکتور است.
اما در محیط فوق بحرانی، سدهای انتقال جرم شکسته میشوند. واکنشگرها بدون مانع فیزیکی با پیوندها برخورد میکنند و انرژی حرارتی بالا، سد انرژی فعالسازی را کوتاه میکند. ما در مقیاس آزمایشگاهی و پایلوت مشاهده میکنیم که زمان واکنش از چند ساعت به ۱۰ تا ۳۰ «دقیقه» کاهش مییابد. این افزایش سرعت، حجم راکتورهای مورد نیاز را کوچکتر کرده و امکان طراحی فرآیندهای پیوسته (Continuous) را به جای فرآیندهای ناپیوسته (Batch) فراهم میکند که برای تولید انبوه صنعتی بسیار حیاتی است.
دی پلیمریزاسیون کاتالیزوری
تا اینجا دیدیم که برای شکستن پیوندهای پلیمری، اغلب به دماهای بسیار بالا یا فشارهای سنگین نیاز داریم. اما در دی پلیمریزاسیون کاتالیزوری، ما مسیر سومی را انتخاب میکنیم. در این روش، با معرفی یک ماده واسط (کاتالیزور) به محیط واکنش، مسیری جدید و کمانرژی برای شکستن پیوندها ایجاد میکنیم. این رویکرد به ما اجازه میدهد تا فرآیند برگشت پذیری پلیمری را در دماهای بسیار پایینتر انجام دهیم که نتیجه آن کاهش مصرف سوخت، افزایش ایمنی فرآیند و جلوگیری از تخریبهای ناخواسته حرارتی است.
کاهش انرژی فعالسازی واکنش برگشت
هر واکنش شیمیایی برای شروع، نیاز به عبور از یک سد انرژی دارد که به آن «انرژی فعالسازی» ($E_a$) میگوییم. پیوندهای کربن-کربن در پلیمرها بسیار پایدار هستند و سد انرژی بلندی دارند. در روشهای حرارتی ساده، ما مجبوریم با افزایش شدید دما، انرژی جنبشی مولکولها را آنقدر بالا ببریم تا بتوانند از این سد عبور کنند.
نقش کاتالیزور در اینجا، پایین آوردن ارتفاع این سد است. کاتالیزور با تشکیل پیوندهای موقت با زنجیره پلیمری، وضعیت گذار (Transition State) را پایدارتر میکند. این کار باعث میشود که پیوندها با انرژی کمتری بشکنند. برای مثال، اگر پیرولیز پلیاتیلن به تنهایی در دمای ۴۵۰ درجه انجام شود، با حضور کاتالیزور مناسب میتوان همین دی پلیمریزاسیون را در دمای ۳۰۰ تا ۳۵۰ درجه با سرعت مشابه یا حتی بیشتر انجام داد. این اختلاف دما در مقیاس صنعتی به معنای میلیونها دلار صرفهجویی در هزینه انرژی است.
استفاده از کاتالیزورهای زئولیتی
یکی از پرکاربردترین خانوادههای کاتالیزور در صنعت بازیافت، زئولیتها (Zeolites) هستند. زئولیتها آلومینوسیلیکاتهای کریستالی متخلخل هستند که ساختاری قفسمانند دارند. این مواد دارای سایتهای اسیدی قوی در سطح و درون حفرههای خود هستند که مثل قیچیهای شیمیایی عمل میکنند.
مکانیسم عمل زئولیتها بر پایه «اسیدیته جامد» است. سایتهای اسیدی، پروتون ($H^+$) را به زنجیره پلیمری منتقل کرده و باعث ایجاد کربوکاتیون میشوند. کربوکاتیون ایجاد شده بسیار ناپایدار است و باعث شکستن سریع زنجیره (بتا-سیژن) میشود. ویژگی منحصربهفرد زئولیتها، «گزینشگری ابعادی» (Shape Selectivity) آنهاست. از آنجا که حفرات زئولیت اندازه مشخصی دارند، تنها مولکولهایی با اندازه خاص اجازه ورود یا خروج دارند. این یعنی ما میتوانیم با انتخاب زئولیت مناسب، تعیین کنیم که محصول خروجی دی پلیمریزاسیون دقیقاً در چه محدوده کربنی (مثلاً بنزین، دیزل یا مونومر سبک) باشد.
کاتالیزورهای مایع یونی (Ionic Liquids)
نسل جدیدی از کاتالیزورها که توجه بسیاری از محققان را جلب کرده، مایعات یونی هستند. این مواد در واقع نمکهایی هستند که در دمای محیط یا پایینتر از ۱۰۰ درجه سانتیگراد به صورت مایع وجود دارند. برخلاف حلالهای آلی فرار، مایعات یونی فشار بخار بسیار ناچیزی دارند و وارد اتمسفر نمیشوند، به همین دلیل به آنها «حلالهای سبز» میگویند.
در فرآیند دی پلیمریزاسیون، مایعات یونی نقش دوگانه حلال و کاتالیزور را بازی میکنند. ساختار شیمیایی آنها (شامل کاتیون و آنیون) قابل طراحی و مهندسی است. ما میتوانیم اسیدیته آنها را طوری تنظیم کنیم که دقیقاً پیوند خاصی را هدف قرار دهند. مطالعات نشان میدهد که استفاده از مایعات یونی اسیدی برای بازیافت پلیمرهای سختجان مثل نایلون یا PET، بازدهی بسیار بالایی دارد و امکان جداسازی آسان کاتالیزور و استفاده مجدد از آن را فراهم میکند که از نظر اقتصادی بسیار جذاب است.
دی پلیمریزاسیون با امواج مایکروویو
زمانی که از روشهای حرارتی معمول (مثل کورهها یا هیترهای روغنی) استفاده میکنیم، گرما باید از دیواره بیرونی راکتور عبور کرده و لایه به لایه به مرکز مخلوط واکنشی نفوذ کند. از آنجا که پلیمرها ذاتاً عایقهای حرارتی خوبی هستند، این انتقال حرارت بسیار کند و ناکارآمد است. اما ما در روش دی پلیمریزاسیون با مایکروویو، این محدودیت فیزیکی را دور میزنیم. در این تکنولوژی، انرژی مستقیماً به تکتک مولکولهای درون راکتور منتقل میشود و گرمایش نه از سطح به عمق، بلکه به صورت حجمی (Volumetric) و درونی رخ میدهد. این ویژگی باعث میشود کنترل ما بر شرایط دمایی واکنش برگشت پذیری پلیمری بسیار دقیقتر و سریعتر باشد.
مکانیزم گرمایش دی الکتریک
اساس کار مایکروویو بر پدیده «گرمایش دیالکتریک» استوار است. امواج الکترومغناطیسی مایکروویو دارای میدانهای الکتریکی نوسانکننده با فرکانس بالا هستند. وقتی این امواج به مخلوط واکنشی میتابند، مولکولهایی که دارای گشتاور دو قطبی هستند (مانند حلالهای قطبی یا گروههای عاملی قطبی در خودِ پلیمر مثل گروه استری در PET)، تلاش میکنند خود را با جهت متغیر میدان همراستا کنند.
این چرخش و نوسان سریع مولکولها (میلیونها بار در ثانیه)، باعث ایجاد اصطکاک مولکولی شدید میشود. انرژی جنبشی حاصل از این اصطکاک مستقیماً به گرما تبدیل میگردد. نکته جالب توجه برای ما این است که مایکروویو رفتاری «گزینشگر» دارد؛ یعنی انرژی خود را بیشتر روی نقاط قطبی (که معمولاً همان نقاط هدف برای شکستن پیوند هستند) متمرکز میکند. این گرمایش موضعی در سطح مولکولی (Hot Spots)، انرژی لازم برای دی پلیمریزاسیون را دقیقاً در جایی که نیاز است، فراهم میکند.
کاهش زمان واکنش برگشت
یکی از چشمگیرترین نتایج استفاده از مایکروویو، شتاب دادن به سینتیک واکنش است. در روشهای رسانایی سنتی (Conduction Heating)، زمان زیادی صرف گرم کردن توده مواد و رسیدن به دمای واکنش میشود. اما در مایکروویو، این زمان تأخیر تقریباً حذف میشود.
تحقیقات و تجربیات عملی نشان میدهند واکنشهایی که در روشهای متداول گلیکولیز یا هیدرولیز به ۴ تا ۸ ساعت زمان نیاز دارند، با استفاده از مایکروویو میتوانند در کمتر از ۳۰ دقیقه تکمیل شوند. این افزایش سرعت صرفاً به دلیل گرمایش سریع نیست؛ بلکه میدان الکترومغناطیسی با برهمکنش مستقیم با ساختار الکترونی پیوندها، احتمال برخورد موثر بین واکنشگرها و زنجیره پلیمری را افزایش میدهد و فرآیند برگشت پذیری پلیمری را تسهیل میکند.
بازدهی انرژی در روش مایکروویو
در مقیاس صنعتی، هزینه انرژی فاکتور تعیینکنندهای است. در کورههای سنتی، بخش بزرگی از انرژی صرف گرم کردن بدنه راکتور، عایقها و هوای اطراف میشود و تنها بخشی از آن به مواد واکنشدهنده میرسد. اما مایکروویو انرژی را مستقیماً به ماده هدف تزریق میکند (Energy Focusing).
ظروف راکتور مایکروویو معمولاً از موادی ساخته میشوند که امواج را عبور میدهند (مانند تفلون یا شیشه کوارتز) و خودشان گرم نمیشوند. بنابراین، اتلاف انرژی به محیط به حداقل میرسد. این راندمان بالای انرژی، دی پلیمریزاسیون با مایکروویو را به گزینهای جذاب برای توسعه پایدار تبدیل کرده است، چرا که با مصرف برق کمتر، همان مقدار محصول مونومر را تولید میکند.
دی پلیمریزاسیون اولتراسونیک (فراصوت)
استفاده از امواج صوتی با فرکانس بالا (اولتراسونیک) رویکردی متفاوت در شکستن زنجیرههای پلیمری است. در این روش، انرژی مکانیکی از طریق امواج صوتی به محلول پلیمری منتقل میشود. نکته متمایز کننده این تکنیک در این است که شکست پیوندها ناشی از برخورد مستقیم امواج نیست، بلکه نتیجه پدیدههای هیدرودینامیکی شدید در مقیاس میکرونی است. دی پلیمریزاسیون اولتراسونیک به دلیل ماهیت غیرحرارتیاش، برای پلیمرهای حساس به دما یا زمانی که نیاز به کاهش دقیق وزن مولکولی بدون تغییر ساختار شیمیایی مونومرها داریم، کاربرد فراوانی دارد.
پدیده کاویتاسیون (Cavitation) و تخریب مکانیکی
مکانیسم اصلی در این روش، پدیدهای به نام «کاویتاسیون آکوستیک» است. وقتی امواج فراصوت از درون یک مایع عبور میکنند، نواحی متناوبی از فشار بالا (تراکم) و فشار پایین (انبساط) ایجاد میکنند. در سیکلهای فشار پایین، حبابهای میکروسکوپی خلأ در مایع شکل میگیرند. این حبابها با جذب انرژی رشد کرده و ناگهان در سیکل فشار بالا به شدت متلاشی میشوند (Implosion).
فروپاشی این حبابها، امواج ضربهای (Shock waves) و جریانهای برشی بسیار قدرتمندی در اطراف حباب ایجاد میکند. اگر یک زنجیره پلیمری بلند در نزدیکی این حباب باشد، نیروهای برشی دو انتهای زنجیره را در جهات مخالف میکشند. این کشش مکانیکی آنقدر زیاد است که پیوند کووالانسی کربن-کربن در وسط زنجیره توان تحمل آن را ندارد و پاره میشود. در واقع، ما در اینجا زنجیره را به صورت فیزیکی از وسط نصف میکنیم. این فرآیند باعث برگشت پذیری پلیمری در سطح فیزیکی و کاهش طول زنجیره میشود.
کنترل وزن مولکولی با شدت امواج
یکی از ویژگیهای بارز روش اولتراسونیک، قابلیت کنترل دقیق بر روی وزن مولکولی نهایی است. برخلاف روشهای شیمیایی که ممکن است تا حد مونومر پیش بروند، در روش فراصوت مفهومی به نام «وزن مولکولی حد» ($M_{lim}$) وجود دارد.
نیروهای برشی ناشی از کاویتاسیون تنها بر زنجیرههایی اثر میگذارند که طول آنها از یک حد مشخص بیشتر باشد. زنجیرههای کوتاهتر میتوانند با جریان سیال حرکت کنند و دچار کشش و شکست نشوند. با تنظیم شدت (Intensity) و فرکانس امواج صوتی، میتوانیم دقیقاً تعیین کنیم که شکست زنجیرهها در چه طولی متوقف شود. این قابلیت به مهندسان اجازه میدهد تا پلیمرهایی با توزیع وزن مولکولی بسیار باریک و مشخص تولید کنند که در صنایع داروسازی و تولید نانوکامپوزیتها کاربرد حیاتی دارد.
کاربرد در محلولهای پلیمری رقیق
محدودیت اصلی دی پلیمریزاسیون اولتراسونیک این است که عمدتاً در فاز مایع و محلول کارایی دارد. امواج صوتی در محیطهای جامد یا ویسکوز (مثل مذاب پلیمر) به سرعت میرا میشوند و پدیده کاویتاسیون شکل نمیگیرد. بنابراین، این روش برای بازیافت تودههای ضایعات پلاستیکی جامد مناسب نیست.
کاربرد اصلی آن در اصلاح خواص محلولهای پلیمری، کاهش ویسکوزیته صمغها، یا بازیافت پلیمرهایی است که قبلاً در یک حلال حل شدهاند. همچنین در تصفیه پسابهای صنعتی حاوی پلیمرهای محلول در آب (مانند پلیآکریلآمید)، استفاده از فراصوت روشی مؤثر برای شکستن زنجیرهها و تسهیل تصفیه بیولوژیکی بعدی محسوب میشود.
بررسی دی پلیمریزاسیون در پلی استایرن (PS)
پلی استایرن (PS) که ما آن را بیشتر در قالب ظروف یکبار مصرف، فومهای بستهبندی و یونولیت میشناسیم، یکی از بهترین کاندیداها برای بازیافت به روش دی پلیمریزاسیون است. برخلاف بسیاری از پلاستیکها که در اثر حرارت تبدیل به قیر یا زغال میشوند، پلی استایرن تمایل ذاتی عجیبی دارد که به مونومر اولیه خود، یعنی مایع استایرن بازگردد. این ویژگی منحصربهفرد باعث شده است که بازیافت شیمیایی آن از نظر اقتصادی بسیار جذاب باشد و پروژههای صنعتی متعددی بر پایه تبدیل «فوم به مایع» شکل بگیرد.
دمای سقف پایین استایرن
راز این برگشتپذیری عالی را باید در ساختار مولکولی آن جستجو کنیم. در زنجیره پلی استایرن، روی هر دو اتم کربن، یک گروه حجیم فنیل (حلقه بنزنی) قرار گرفته است. حضور این گروههای بزرگ در کنار هم باعث ایجاد دافعه و «ممانعت فضایی» میشود. این فشار داخلی باعث میشود که پیوندهای زنجیره نسبت به گرما حساس باشند.
به همین دلیل، پلی استایرن دارای دمای سقف ($T_c$) نسبتاً پایینی (حدود ۳۱۰ درجه سانتیگراد) است. این یعنی به محض اینکه دمای پلیمر از این حد فراتر رود، ترمودینامیک سیستم حکم میکند که پلیمر ناپایدار شود. در این شرایط، تعادل واکنش به نفع دی پلیمریزاسیون تغییر جهت میدهد. برای مهندسان فرآیند، این یک مزیت بزرگ است؛ زیرا نیاز به دماهای عجیب و غریب نیست و با یک حرارتدهی کنترل شده میتوان ساختار جامد را فرو ریخت.
بازیافت مونومر استایرن با حرارت
وقتی پلی استایرن را در محیطی بدون اکسیژن (پیرولیز) حرارت میدهیم، مکانیسم غالب، همان مکانیسم «زیپی» است که قبلاً بررسی کردیم. رادیکالهای ایجاد شده در انتهای زنجیره، به سرعت و دانه به دانه واحدهای استایرن را جدا میکنند.
تحقیقات و دادههای عملیاتی نشان میدهند که اگر فرآیند به درستی کنترل شود، میتوانیم به راندمان تبدیل بیش از ۷۰ تا ۹۰ درصد دست پیدا کنیم. یعنی از هر ۱۰ کیلوگرم ضایعات یونولیت، حدود ۷ تا ۹ کیلوگرم مونومر استایرن مایع به دست میآید. این مایع استایرن، پس از تصفیه، دقیقاً همان خواص ماده پتروشیمیایی اولیه را دارد و میتواند دوباره پلیمریزه شده و به پلی استایرن بکر (Virgin) تبدیل شود، بدون اینکه افتی در خواص مکانیکی یا نوری آن ایجاد گردد.
مدیریت ناخالصیها در بازیافت PS
اگرچه برگشت پذیری پلیمری در آزمایشگاه عالی است، اما در دنیای واقعی با چالش ناخالصیها روبرو هستیم. ضایعات پلی استایرن معمولاً آغشته به مواد غذایی، چسب لیبل، و یا مخلوط با سایر پلاستیکها (مانند دربهای PP) هستند.
در فرآیند دی پلیمریزاسیون، برخی از این ناخالصیها نیز تجزیه شده و موادی تولید میکنند که نقطه جوشی نزدیک به استایرن دارند (مانند اتیل بنزن یا تولوئن). حضور این مواد میتواند رنگ و بوی مونومر بازیافتی را تغییر دهد. بنابراین، بخش حیاتی در صنعت بازیافت PS، واحد تقطیر جزء به جزء (Fractional Distillation) است که پس از راکتور قرار میگیرد. در این واحد، با تکیه بر اختلاف نقطه جوش، مونومر استایرن از سایر مایعات و روغنهای سنگین جدا میشود تا به خلوص پلیمریزاسیون (بالای ۹۹.۸ درصد) برسد.
بررسی دی پلیمریزاسیون در PMMA (پلکسی)
در میان پلاستیکهای تجاری، پلیمتیلمتاکریلات (PMMA) یکی از کارآمدترین فرآیندهای برگشت پذیری پلیمری را دارد. در حالی که بازیافت بسیاری از پلیمرها با افت خواص همراه است، PMMA این قابلیت ترمودینامیکی را دارد که با راندمان بالا به مونومر اولیه خود بازگردد. این ویژگی فنی باعث شده است تا در صنایع تولید ورقهای اکریلیک، ضایعات فرآیند و قطعات مصرف شده، به عنوان منبعی برای تولید مجدد مونومر (MMA) مورد استفاده قرار گیرند.
بازدهی بالای تبدیل به مونومر (SMA)
علت اصلی بازدهی بالا در PMMA، ساختار شیمیایی ویژه آن است. در زنجیره اصلی این پلیمر، روی کربنهایی که شاخه جانبی دارند، اتم هیدروژن وجود ندارد (کربن نوع چهارم). فقدان هیدروژن روی کربن آلفا مانع از انجام واکنشهای انتقال زنجیره و «شکست تصادفی» میشود. در نتیجه، زمانی که انرژی حرارتی به پلیمر اعمال میشود، رادیکالها مسیر «زیپی» (Unzipping) را طی میکنند.
این ساختار مولکولی باعث میشود که در شرایط بهینه عملیاتی، بیش از ۹۷ درصد وزن پلیمر ورودی به صورت مونومر متیلمتاکریلات (MMA) بازیابی شود. به عبارت دیگر، تولید ضایعات جانبی، زغال یا ترکیبات سبک در فرآیند دی پلیمریزاسیون PMMA بسیار ناچیز است. این خلوص بالا در محصول خروجی، عامل اصلی توجیه اقتصادی در بازیافت شیمیایی این پلیمر محسوب میشود.
روش حمام سرب مذاب
یکی از تکنیکهای سنتی که برای انتقال حرارت سریع به PMMA توسعه یافته، استفاده از «حمام سرب مذاب» است. هرچند امروزه به دلایل زیستمحیطی روشهای بستر سیال جایگزین آن میشوند، اما بررسی فنی آن اصول انتقال حرارت را روشن میکند. در این روش، قطعات خرد شده پلکسی به داخل مخزنی از سرب مذاب با دمای حدود ۵۰۰ درجه سانتیگراد وارد میشوند.
سرب مذاب به دلیل ضریب انتقال حرارت بالا، انرژی را به صورت فوری و یکنواخت به ذرات پلیمر منتقل میکند. این شوک حرارتی باعث میشود دی پلیمریزاسیون قبل از وقوع واکنشهای جانبی یا سوختگی سطحی رخ دهد و مونومر به سرعت تبخیر شود. بخارات حاصل جمعآوری شده و در کندانسورها به مایع تبدیل میشوند.
تقطیر و خالص سازی متیل متاکریلات
محصول مایع خروجی از راکتور، «متیل متاکریلات بازیافتی» یا r-MMA نامیده میشود. این مایع با وجود درصد بالای مونومر، ممکن است حاوی مقادیر کمی از رنگدانهها یا افزودنیهای اولیه باشد. برای استفاده مجدد در تولید ورقهای شفاف، r-MMA باید مراحل خالصسازی را طی کند.
با توجه به نقطه جوش مشخص MMA (۱۰۰ درجه سانتیگراد)، استفاده از برجهای تقطیر دقیق امکان جداسازی کامل مونومر از ناخالصیهای سنگینتر را فراهم میکند. بررسیهای آزمایشگاهی نشان میدهند که مونومر تقطیر شده، خواص شیمیایی مشابه با مونومر پتروشیمیایی (Virgin) دارد و میتواند بدون مشکل در فرآیند پلیمریزاسیون مجدد استفاده شود.
بررسی دی پلیمریزاسیون در پلی اتیلن ترفتالات (PET)
پلیاتیلن ترفتالات (PET) حجم عظیمی از ضایعات پلاستیکی جهان، از بطریهای آب و نوشابه گرفته تا الیاف پلیاستر در لباسها را تشکیل میدهد. در حالی که بازیافت مکانیکی (خرد کردن و ذوب مجدد) برای این پلیمر مرسوم است، اما این روش با هر بار تکرار باعث افت خواص و زرد شدن محصول میشود. به همین دلیل، ما در صنعت به دنبال راهکاری پایدارتر هستیم. دی پلیمریزاسیون PET این امکان را فراهم میکند که ضایعات بیآرزش را دقیقاً به همان مواد اولیهای تبدیل کنیم که در پتروشیمی تولید میشوند، بدون اینکه افتی در کیفیت نهایی ایجاد شود.
مقایسه روشهای گلیکولیز و هیدرولیز برای PET
در بخشهای قبل اصول کلی هیدرولیز و گلیکولیز را بررسی کردیم، اما در مورد خاص PET، انتخاب بین این دو روش به هدف نهایی ما بستگی دارد. اگر هدف ما تولید اسید ترفتالیک (TPA) باشد، هیدرولیز گزینه مستقیمتری است، اما چالشهای خوردگی تجهیزات و مدیریت پساب اسیدی/بازی هزینه عملیاتی را بالا میبرد.
در مقابل، گلیکولیز به دلیل شرایط عملیاتی ملایمتر و تولید مونومر BHET، در مقیاس صنعتی محبوبیت بیشتری یافته است. BHET میتواند مستقیماً در راکتورهای پلیمریزاسیون موجود در کارخانهها استفاده شود. بررسیهای فنی نشان میدهد که گلیکولیز تعادل بهتری بین هزینه انرژی و کیفیت محصول برقرار میکند و فرآیند برگشت پذیری پلیمری را با پیچیدگی کمتری نسبت به هیدرولیز محقق میسازد.
چالشهای بازیافت شیمیایی بطریهای رنگی
یکی از معضلات بزرگ در بازیافت PET، وجود رنگدانهها در بطریهای سبز، قهوهای یا آبی است. در بازیافت مکانیکی، این بطریها نمیتوانند به بطری شفاف تبدیل شوند. اما در دی پلیمریزاسیون، ما فرصت داریم که رنگ را حذف کنیم.
با این حال، رنگدانهها میتوانند در فرآیند اختلال ایجاد کنند. برخی رنگدانههای آلی ممکن است در حین واکنش تجزیه شده و مونومر را آلوده کنند. در روشهایی مثل گلیکولیز، نیاز به سیستمهای فیلتراسیون کربن فعال پیشرفته داریم تا رنگ را از محلول BHET جدا کنیم. در مواردی که آلودگی رنگی بسیار شدید است، روش متانولیز (به دلیل تولید DMT و امکان تقطیر و تبلور مجدد آن) قدرت بالاتری در حذف رنگدانهها و ارائه محصولی کاملاً سفید و خالص دارد.
تبدیل مجدد به گرانول گرید غذایی
مهمترین مزیت دی پلیمریزاسیون PET، قابلیت تولید محصول «گرید غذایی» (Food Grade) است. نهادهای نظارتی مانند FDA و EFSA قوانین سختگیرانهای برای پلاستیکهای بازیافتی در تماس با مواد غذایی دارند. در بازیافت مکانیکی، همیشه احتمال باقی ماندن آلایندههای شیمیایی در بافت پلاستیک وجود دارد.
اما در فرآیند دی پلیمریزاسیون، ساختار پلیمر کاملاً منهدم میشود. هرگونه آلودگی میکروبی، شیمیایی یا بو که در دیواره بطری نفوذ کرده باشد، در طی مراحل شکستن مولکولی، فیلتراسیون و تبلور مجدد مونومر به طور کامل حذف میشود. مونومر خالص حاصله، هیچ تفاوتی با مونومر بکر ندارد و پلیمری که از آن ساخته میشود، از نظر ایمنی و بهداشت کاملاً استاندارد است. این ویژگی کلیدی، دی پلیمریزاسیون را به تنها راهکار مطمئن برای چرخه «بطری به بطری» بیپایان تبدیل میکند.
بررسی دی پلیمریزاسیون در پلی آمیدها (نایلون)
پلیآمیدها که در صنعت بیشتر با نام تجاری نایلون شناخته میشوند، دستهای از پلیمرهای مهندسی هستند که کاربردهای وسیعی از الیاف فرش و لباس تا قطعات خودرو و تورهای ماهیگیری دارند. بازیافت مکانیکی نایلونها اغلب با مشکلاتی نظیر افت شدید خواص و اکسیداسیون حرارتی همراه است. به همین دلیل، رویکرد دی پلیمریزاسیون برای این مواد، به ویژه نایلون ۶، اهمیتی استراتژیک دارد. در این فرآیند، هدف ما بازگرداندن زنجیره پلیمری به مواد اولیه شیمیایی است تا بتوانیم نایلونی با کیفیتِ مشابه نایلون بکر تولید کنیم.
هیدرولیز نایلون ۶ به کاپرولاکتام
نایلون ۶ یک ویژگی منحصربهفرد دارد؛ این پلیمر از پلیمریزاسیون گشایش حلقه (Ring-Opening Polymerization) یک مونومر حلقوی به نام «کاپرولاکتام» سنتز میشود. خبر خوب برای ما این است که این واکنش کاملاً تعادلی و برگشتپذیر است.
اگر نایلون ۶ را در حضور کاتالیزورهای اسیدی (مانند اسید فسفریک) و بخار آب سوپرهیت شده حرارت دهیم، واکنش معکوس فعال میشود. در این فرآیند دی پلیمریزاسیون، زنجیرههای خطی دوباره به حالت حلقوی خود باز میگردند و کاپرولاکتام خام تولید میشود. این کاپرولاکتام پس از تقطیر و خالصسازی، هیچ تفاوتی با ماده تولید شده در پتروشیمی ندارد. این چرخه بسته، یکی از کارآمدترین نمونههای برگشت پذیری پلیمری در صنعت است که اجازه میدهد فرشهای کهنه را دوباره به الیاف تازه تبدیل کنیم.
بازیافت شیمیایی تورهای ماهیگیری
یکی از منابع بزرگ ضایعات نایلونی، تورهای ماهیگیری مستعمل هستند که رها شدن آنها در دریاها (تورهای شبح) معضلات زیستمحیطی جدی ایجاد میکند. این تورها معمولاً از نایلون ۶ با کیفیت بالا ساخته میشوند، اما به دلیل تماس طولانی با آب شور و نور خورشید و همچنین آلودگی شدید به مواد آلی دریایی، بازیافت مکانیکی آنها دشوار و غیراقتصادی است.
در اینجا، دی پلیمریزاسیون شیمیایی راهگشاست. فرآیند شیمیایی اهمیتی به کثیفی ظاهری تور نمیدهد. در راکتور بازیافت، ساختار نایلون شکسته شده و به مونومر تبدیل میشود، در حالی که آلودگیها و نمکها به صورت تفاله جامد جدا میشوند. این روش به ما امکان میدهد تا از دل زبالههای دریایی، ماده اولیه باارزشی استخراج کنیم که میتواند دوباره در تولید پوشاک ورزشی یا قطعات صنعتی استفاده شود.
تفاوت رفتار نایلون ۶ و ۶۶ در برگشت پذیری
همه نایلونها رفتار یکسانی در برابر دی پلیمریزاسیون ندارند. تفاوت اصلی بین نایلون ۶ و نایلون ۶۶ در ساختار مونومرهای آنهاست. نایلون ۶ از یک نوع مونومر ساخته شده، در حالی که نایلون ۶۶ از همسپاری دو ماده مختلف (هگزامتیلن دیآمین و اسید آدیپیک) به وجود میآید.
بازیافت شیمیایی نایلون ۶۶ بسیار پیچیدهتر است. در حالی که نایلون ۶ تمایل دارد به راحتی به حلقه کاپرولاکتام برگردد، نایلون ۶۶ چنین مسیر سادهای ندارد. برای شکستن نایلون ۶۶، باید پیوندهای آمیدی را هیدرولیز کنیم که منجر به تولید مخلوطی از دیآمین و دیاسید در فاز آبی میشود. جداسازی و خالصسازی این دو جزء از یکدیگر بسیار پرهزینهتر از تقطیر ساده کاپرولاکتام است. به همین دلیل، پروژههای صنعتی دی پلیمریزاسیون نایلون ۶ بسیار رایجتر و موفقتر از نایلون ۶۶ هستند.